Ионная атмосфера
Cтраница 4
Плотность ионной атмосферы различна. Наибольший избыток отрицательных зарядов находится вблизи иона. По мере удаления от центрального иона плотность избыточного заряда становится вое меньшей и меньшей, и на некотором расстоянии от иона количество отрицательных и положительных зарядов становится одинаковым; на этом и заканчивается ионная атмосфера. Следовательно, ионная атмосфера имеет некоторые конечные размеры; она характеризуется определенной длиной и плотностью. Чем разбавленнее раствор, тем ионная атмосфера имеет меньшую плотность, занимает больший объем и имеет большую длину. Чем концентрированнее раствор, тем плотность ионной атмосферы становится больше, а длина атмосферы соответственно меньше. С повышением температуры плотность ионной атмосферы уменьшается за счет увеличения кинетической энергии ионов. [46]
Плотность ионной атмосферы различна. Наибольший избыток отрицательных зарядов находится вблизи иона. По мере удаления от центрального иона плотность избыточного заряда становится все меньшей и меньшей, и на некотором расстоянии от иона количество отрицательных и положительных зарядов становится одинаковым; на этом и заканчивается ионная атмосфера. Следовательно, ионная атмосфера имеет некоторые конечные размеры; она характеризуется определенной длиной и плотностью. Чем разбавленнее раствор, тем ионная атмосфера менее плотна и занимает больший объем. Чем концентрированнее раствор, тем плотность ионной атмосферы становится больше, а размер атмосферы соответственно меньше. С повышением температуры плотность ионной атмосферы уменьшается за счет увеличения кинетической энергии ионов. [47]
Образование ионной атмосферы и ассоциация ионов в ионные двойники и тройники не исчерпывают всех обстоятельств, от которых зависит поведение электролитов в растворах. Поведение ионов в растворах в значительной степени зависит от их сольватации в неводных растворах и гидратации в водных растворах. [48]
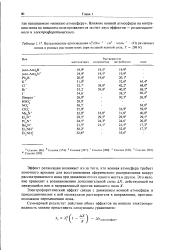 |
Вальденовские произведения м ( Ом - ] см2 моль 1 сП различных ионов в разных растворителях ( при нулевой ионной силе, Т 298 К. [49] |
Влияние ионной атмосферы на миграцию иона во внешнем поле проявляется за счет двух эффектов - релаксационного и электрофоретического. [50]
Толщина ионной атмосферы зависит от концентрации ионов каждого рода и их валентности. Она падает с увеличением валентности ионов электролита, а по мере уменьшения концентрации электролита и повышения температуры или возрастания диэлектрической постоянной растворителя возрастает. [51]
Толщина ионной атмосферы зависит от температуры, диэлектрической проницаемости растворителя, числа и заряда ионов. Величина х непосредственно связана с термодинамическими свойствами ионов. [52]
Образование ионной атмосферы ( что соответствует положению, когда каждый данный ион оказывается окруженным преимущественно ионами противоположного заряда) снижает у в тем большей степени, чем больше заряд иона. Например, при низких моляльностях у солей LaCl3, MgCl2 NaCl уменьшаются справа налево. [53]
Образование ионных атмосфер сопровождается сближением ионов, заряженных разноименно. Это приводит к тому, что в растворе электролита силы взаимного притяжения преобладают над сил ами взаимного отталкивания. Взаимное притяжение между ионами удерживает их друг около друга, что вызывает снижение внешнего давления. В этом отношении реальный раствор электролита имеет глубокое сходство с реальным газом, в котором между молекулами действуют силы взаимного притяжения. [54]
Страницы: 1 2 3 4