Атом - неметалл
Cтраница 3
Подобно этому атомы неметаллов ( хлора, серы, фосфора) присоединяют электроны до восьми-электронной конфигурации во внешнем слое получающихся отрицательных ионов. Вообще атомы с незавершенным внешним слоем как бы проявляют тенденцию приобрести электронную структуру инертных элементов. [31]
Ближайшее окружение атома неметалла ( аниона), занимающего в кристаллической решетке позицию, создающую плотнейшую упаковку, может быть различным: 1) из-за изменения взаимного расположения октаэдрических и тетраэдрических пустот ( слойность структуры); 2) из-за изменения количества заполненных октаэдрических и тетраэдрических пустот. Последнее обстоятельство служит причиной образования дефектных и избыточных структур. [32]
Ближайшее окружение атома неметалла ( аниона), занимающего в кристаллической решетке позицию, создающую плотнейшую упаковку, может быть различным: 1) из-за изменения взаимного расположения октаэдрических и тетраэдрических пустот ( елейность структуры); 2) из-за изменения количества заполненных октаэдрических и тетраэдрических пустот. Последнее обстоятельство служит причиной образования дефектных и избыточных структур. [33]
 |
К рисишличс-ская структура алмача. [34] |
Группа из атомов неметаллов связана с атомами металла ионной связью. Внутри же иона SO42 - связи между атомом серы и атомами кислорода ковалентные полярные. Решетки, образованные такими соединениями - ионные. Вещества, имеющие ионные кристаллические решетки, являются электролитами. [35]
Скорости диффузии атомов неметаллов ( водорода, углерода, бора или азота) могут быть разными; онц, зависят от природы металла и состояния его поверхности, температуры и присутствия или отсутствия поверхностных окисных или других пленок. [36]
Степень окисления атомов неметаллов главных подгрупп в соединениях с менее электроотрицательными элементами равна 8 минус номер группы. [37]
Заполнение пустот атомами неметалла может быть полным или частичным, что объясняет непостоянство стехиометрического состава фаз внедрения. [38]
Их заполнение атомами неметалла приводит к образованию в первом случае структуры каменной соли Со / о, а во втором-к структуре плавикового шпата CCIT - Уже из § 63 мы знаем, что вовсе не всегда имеет место заполнение всех междуузлий данного типа. [39]
Приобретая электроны, атомы неметаллов превращаются в электроотрицательные ионы. [40]
Сильными окислителями являются атомы неметаллов, имеющие внешний электронный слой, близкий к завершенному ( 6, 7 электронов), и проявляющие поэтому преимущественную тенденцию к приему электронов. [41]
Меньшие по размеру атомы неметаллов С, N и Н способны образовывать твердые растворы внедрения. [42]
Как указывалось, атомы неметаллов характеризуются положительными значениями сродства к электрону: при присоединении электрона к такому атому выделяется энергия. Однако присоединение второго электрона к атому любого неметалла требует затраты энергии, так что образование простых многозарядных анионов ( например, 02 -, N3 -) оказывается энергетически невыгодным. Поэтому в таких соединениях, как оксиды ( ВаО, А1оОз и др.) или сульфиды ( например, ZnS, CuS), не образуется чисто ионная связь: здесь химическая связь всегда носит частично ковалентный характер. [43]
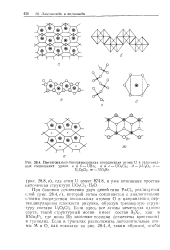 |
Пентагонально-бипирамидальная координация атома U в галогенид-ных соединениях урана, а и б - UBu. в и г - иО2СЬ. 3 - p - UsOs. e. [44] |
Если здесь все атомы неметалла одного сорта, такой структурный мотив имеет состав А2Х7, как в RbIn2F7, где ионы Rb заселяют позиции ( отмечены крестиком) в туннелях. [45]
Страницы: 1 2 3 4