Атом - поверхность - катализатор
Cтраница 1
Атомы поверхности катализатора, принимающие участие в активированной адсорбции, входят в состав мультиплета. [1]
Вследствие малого радиуса действия валентно-химических сил эти атомы должны соприкасаться с атомами поверхности катализаторов. В мультиплетяой теории [12] ( рассматриваются способы такого наложения, принимая во внимание реальные размеры и расположение атомов. При этом в М должно по возможности соблюдаться сохранение валентного угла. Рассмотрение многочисленных применений принципа структурного соответствия ( см. [12, 28]) выходит за рамки настоящего доклада. [2]
Можно думать, что связь lg k с d является следствием действительного участия двух атомов поверхности катализатора в образовании активированного комплекса. На рис. 40, а резко ( за пределы среднего квадратичного отклонения) отклоняются от линии регрессии в положительную сторону полупроводники типа Ge, InAs и другие с малой шириной запрещенной зоны, а также некоторые окислы переходных металлов ( N10), в отрицательную сторону - диэлектрики Si02, BaO, SrO и некоторые другие окислы, о каталитической активности которых имеется мало данных. [3]
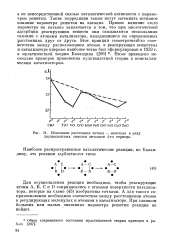 |
Изменение расстояния металл - неметалл в ряду двухвалентных окислов металлов 4-го периода. [4] |
Для осуществления реакции необходимо, чтобы реагирующие атомы А, В, С и D соприкасались с атомами поверхности катализатора, которые на схеме ( 45) изображены точками. А для такого соприкосновения необходимо соответствие между расстояниями атомов в регулирующих молекулах и атомами в катализаторе. [5]
Особо следует отметить предположение, выдвинутое Баландиным ( 1929), согласно которому растяжение адсорбированных молекул происходит между атомами поверхности катализатора, образующими узлы его кристаллической решетки. [6]
 |
Радикальный механизм каталитической реакции С2Не - [ - С12 предложенный Волькенштейном. [7] |
Другая характерная черта этой теории, вполне естественная, заключается в отсутствии учета роли локальной координации ( орбиталей) между атомами поверхности катализатора и адсорбированными частицами. [8]
На основании приведенных выше рассуждений можно заключить, что для реакций, требующих двухточечной адсорбции, должна существовать прямая зависимость между числом пар атомов поверхности катализатора, расположенных с правильными промежутками, и каталитической активностью. Влияние этого фактора было подтверждено работой Бика, Смита и Уилера [9] по гидрированию этилена. В качестве катализаторов они пользовались пленками никеля, отложенными на стекле путем испарения в условиях, при которых слои толщиной около 200 атомов были еще вполне доступны для реагентов. Если катализатор приготовлялся в вакууме, пленка была неориентированной, а в присутствии азота слой был полностью ориентирован к газовой фазе плоскостями ПО, на которых имеются желательные межатомные расстояния; каталитическая активность такого катализатора на единицу поверхности была в 5 раз больше. Изучение катализатора этого типа, проведенное вышеупомянутыми исследователями методами диффракции электронов, дало ценные дополнительные доказательства в защиту постулата о геометрических соотношениях между реагентом и катализатором. [9]
Что касается природы активных центров поверхности катализатора, то Н. Д. Зелинский впервые стал рассматривать их как сложные образования, состоящие из нескольких атомов, так что деформация связей в реагирующей молекуле осуществляется не одним, а несколькими атомами поверхности катализатора, составляющими активный центр. [10]
Что касается природы активных центров поверхности катализатора, то Н. Д. Зелинский впервые стал рассматривать их как сложные образования, состоящие из нескольких атомов, так что деформация связей в реагирующей молекуле осуществляется не одним, а несколькими атомами поверхности катализатора, составляющими активный центр. [11]
Что касается природы активных центров поверхности катализатора, то Н. Д. Зелинский впервые стал рассматривать их как сложные образования, состоящие из нескольких атомов, так что деформация связей в реагирующей молекуле осуществляется не одним, а несколькими близлежащими атомами поверхности катализатора, составляющими активный центр. [12]
 |
Схема электронных уровней полупроводника. [13] |
По схеме 1.11 6 молекула, обладавшая в свободном состоянии двойной связью, в адсорбированном виде приобретает свободную валентность и делается реакционноспособным поверхностным радикалом. В обоих случаях свободная валентность остается ненасыщенной и после акта адсорбции, но перемещается от атома поверхности катализатора к молекуле, участвующей в реакции. Наличие свободной валентности на поверхности является, с точки зрения электронной теории, необходимым, хотя и не всегда достаточным условием протекания реакции в адсорбционном слое. [14]
Согласно этой теории, каталитическая дегидрогенизация имеет место тогда, когда группа атомов на поверхности катализатора, расположенных известным образом и обладающих необходимой активностью, адсорбирует реагирующее вещество в определенным образом ориентированном положении. В связи с тем, что здесь имеет место одновременное действие целой группы атомов поверхности катализатора, упомянутая теория получила название теории мультиплетов. Платина, палладий, иридий, родий, медь, кобальт, никель, железо, цинк, осмий и рутений являются активными катализаторами: они обладают структурой, отвечающей этим условиям. [15]
Страницы: 1 2