Атом - скандий
Cтраница 1
Атомы скандия, иттрия, лантана и актиния имеют по три внешних валентных электрона ( один d - электрон и два s - электрона) и предшествующую заполненную р6 - подоболочку. Вследствие неполного отделения валентных электронов полы в металлическом кристалле имеют внешнюю s - оболочку, сферическую или слегка сжатую, что приводит к плотнейшей кубической или гексагональной упаковке. Этим металлам, так же как и многим лан-танидам, свойствен полиморфизм с плотной гексагональной структурой в качестве низкотемпературной модификации и гране-центрированной кубической в качестве более высокотемпературной. [1]
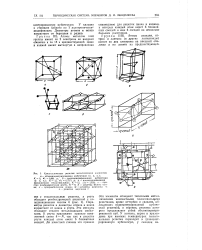 |
Кристаллические решетки металлических элементов. [2] |
Атомы скандия, иттрия и лантана ( и другие лантаноиды) имеют по два электрона на внешней оболочке и по девяти на предшествующей. [3]
 |
Сульфиды с кубической плотнейшей упаковкой атомов S. [4] |
Все атомы скандия занимают октаэдрическне пустоты, так что структура относится к дефектной структуре типа NaCl с упорядоченными вакансиями. [5]
В химических реакциях атомы скандия, иттрия, лантана и актиния отдают 3 электрона ( 2 электрона с внешней s - орбитали и 1 избыточный электрон с d - орбитали), образуя соединения, в которых они проявляют степень окисления, равную трем. Электроположительные ионы элементов подгруппы скандия имеют электронную конфигурацию инертного газа и проявляют некоторое сходство с ионами щелочноземельных металлов при заряде ядра на единицу больше. [6]
И только у атома скандия, порядковый номер 21, начинается заполнение Зе-подуровня. Внешними оказываются и четвертый уровень и Зс1 - подуровень. [7]
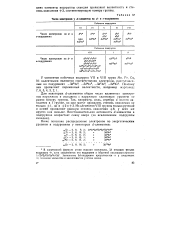 |
Число электронов у d - элементов на d - и s - подуровнях. [8] |
В электронной формуле атома скандия подуровень 3d помешен ряшие подуровня 4s, хотя заполняются эти подуровни в обратной последовательности: I. Заполнение 3d - noflypoBHa продолжается и у следующих зп скандием элементов и заканчивается у атома цинка. [9]
При химических реакциях от атомов скандия, иттрия и лантана могут отрываться по три электрона. Эти металлы являются сильными восстановителями; из них наиболее активен лантан. Примыкающие к лантану лантаноиды также являются сильными восстановителями, активность которых от церия к лютецию уменьшается. Первые пять элементов от церия до европия, включая лантан, называются цериевыми или церитовыми элементами. Остальные элементы вместе с иттрием называются ит-триевыми элементами. Они являются более тугоплавкими металлами, чем цериевые. Упомянутое деление основано на том, что в одних природных минералах сосредоточены преимущественно цериевые элементы, из которых наиболее распространенным является церий, а в других - иттрий вместе с остальными элементами. [10]
Молекула окиси состоит из двух атомов скандия и трех атомов кислорода. [11]
Возбуждение и спиновое расщепление остовных р6 - оболочек атомов скандия, титана, циркония, гафния, технеция, рения при их растворении в ОЦК металлах V-VI групп ведет к переходу этих металлов в ОЦК состояние ниже температур их полиморфного ПГ-ОЦК ( а-р) превращения. Перекрытию и расщеплению их остовных р6 - оболочек способствуют большие атомные радиусы этих металлов: при замещении атома металла V-VI групп атом титана, циркония, гафния будет зажат соседними атомами растворителя, а следовательно, перейдет в возбужденное состояние. V-VI групп приводит к расширению области ОЦК твердых растворов за счет подавления и выклинивания областей плотных гексагональных а-растворов. [12]
При этом масс-спектрометрически в парах скандия были обнаружены только атомы скандия. [13]
При этом масс-спектрометрически в парах скандия были обнаружены только атомы скандия. [14]
Таким образом, спектры исследованных соединений согласуются с представлением о бидентатной координации анионов с атомами скандия. [15]
Страницы: 1 2 3