Атом - благородный газ
Cтраница 3
Аналогичные опыты с атомами благородных газов [193, 194, 198] показали наличие в газовой среде в режиме сверхзвукового потока ван-дер-ваальсовых молекул Аг2 ( г ( Аг-Аг) 3 39 0 06 А) и Хе2 ( г ( Хе-Хе) 4 41 0 03 А), причем соответствующие среднеквадратичные амплитуды колебаний составляли приблизительно 2 5 % от величины длины связи. В этом исследовании установлены также симметрия и размеры элементарной ячейки кристалла и определены межъядерные расстояния в кристалле вплоть до 13 552 А. [31]
Максимальную устойчивость проявляют также атомы благородных газов ( Не, Ne, Ar, Kr, Xe, Rn), которые с трудом вступают в химическое взаимодействие с атомами других элементов ( отсюда их старое групповое название - инертные газы, которое теперь не используется), Атомы этих элементов содержат по 8е - ( октет электронов) на высшем ( для каждого элемента) энергетическом уровне. [32]
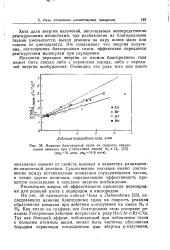 |
Влияние благородных газов на скорость образования аммиака при у-облучении смесей N2 и Н2 ( pN234 атм, рнг14 6 атм. [33] |
Механизм передачи энергии от атомов благородного газа может быть связан либо с переносом заряда, либо с передачей энергии возбуждения. [34]
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. Были известны лишь сравнительно нестойкие молекулярные соединения благородных газов - например, гидраты Аг - 6Н2О, Кг - 6Н2О, Хе - 6Н2О, образующиеся при действии сжатых благородных газов на кристаллизующуюся переохлажденную воду. Эти гидраты принадлежат к типу клатратов ( см. § 72); валентные связи при образовании подобных соединений не возникают. [35]
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. Были известны лишь сравнительно нестойкие молекулярные соединения благородных газов - например, гидраты Аг - бНаО, Кг - 6Н2О, Хе - 6Н2О, образующиеся при действии сжатых благородных газов на кристаллизующуюся переохлажденную воду. Эти гидраты принадлежат к типу клатратов ( см. § 72); валентные связи при образовании подобных соединений не возникают. Однако в течение последних десятилетий было установлено, что криптон, ксенон и радон способны вступать в соединение с другими элементами и прежде всего с фтором. Все они представляют собой кристаллы, устойчивые при обычных условиях. [36]
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. Были известны лишь сравнительно нестойкие молекулярные соединения благородных газов - например, гидраты Аг - 6Н2О, Кг - 6Н2О, Хе - 6Н2О, образующиеся при действии сжатых благородных газов на кристаллизующуюся переохлажденную воду. Эти гидраты принадлежат к типу клатратов ( см. § 72); валентные связи при образовании подобных соединений не возникают. [37]
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. Бь лп известны лишь срарннтельно нестойкие молекулярные соединения благородных газов - например, гидраты Аг-о гЬО, Кг - 6Н) О, Хе - 6Н:) О, образующиеся при действии сжатых благ-гюдных газов на кристаллизующуюся переохлажденную воду. Эти гидраты принадлежат к типу к л г, т р а т о в ( см. § 72; валентные связи при образовании подобных соединений не возникают. Образованию клатратов с водой благоприятствует наличие в кри-ст. [38]
 |
Некоторые свойства благородных газов и их содержание в воздухе. [39] |
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других Элементов. [40]
 |
Некоторые свойства благородных газов и их содержание в воздухе. [41] |
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. Были известны лишь сравнительно нестойкие моле. [42]
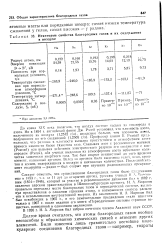 |
Некоторые свойства благородных газов и их содержание в воздухе. [43] |
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. [44]
Долгое время считалось, что атомы благородных газов вообще неспособны к образованию химических связей с атомами других элементов. Были известны лишь сравнительно нестойкие молекулярные соединения благородных газов - например, гидраты Аг - 6Н2О, Кг - 6Н2О, Хе - 6Н2О, образующиеся при действии сжатых благородных газов на кристаллизующуюся переохлажденную воду. Эти гидраты принадлежат к типу клатратов ( см. § 72); валентные связи при образовании подобных соединений не возникают. [45]
Страницы: 1 2 3 4 5