Разный атом
Cтраница 1
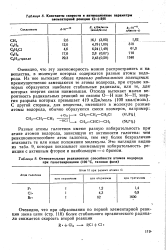 |
Константы скорости и актнвационные параметры элементарное реакции C1 - RH.| Относительные реакционные способности атомов водорода при галогенировании ( 100 С, газовая фаза. [1] |
Разные атомы галогенов имеют разную избирательность при-атаке атомов водорода, зависящую от активности галогена: чем реакционноспособнее атом галогена, тем ему более безразлично-атаковать те или иные положения молекулы. Это наглядно видно-из табл. 9, которая показывает наименьшую избирательность реакции с активным фтором и наибольшую - с бромом. [2]
 |
Относительные реакционные способности атомов водорода при галогенировании ( 100 С, газовая фаза.| Тепловые эффекты стадий продолжения цепи. [3] |
Разные атомы галогенов проявляют разную избирательность при атаке атомов водорода, зависящую от активности галогена; чем реакционноспособнее атом галогена, тем менее избирательно он атакует те или иные положения молекулы. Это наглядно видно из данных табл. 17, которые показывают наименьшую избирательность реакции с активным фтором и наибольшую - с бромом. [4]
АО разных атомов, что приводит к получению неатомных базисов, как, скажем, в случае трансформации АО в групповые орбитали, преобразующиеся по неприводимым представлениям ( НП) точечной группы симметрии молекулы. [5]
Валентности разных атомов в молекуле взаимно насыщены. [6]
АО разных атомов, что приводит к получению неатомных базисов, как, скажем, в случае трансформации АО в групповые орбитали, преобразующиеся по неприводимым представлениям ( НП) точечной группы симметрии молекулы. [7]
 |
Схема возникновения ad -, itd - и б - связей. [8] |
Между разными атомами чистая ковалентная связь может проявляться, если ЭО атомов одинакова. [9]
В разных атомах содержится различное количество протонов, нейтронов и электронов. Наиболее тяжелые атомы насчитывают около 350 таких частиц. [10]
При сочетании разных атомов образуется сложное вещество, или химическое соединение. Путем соответствующих химических операций всякое сложное вещество может быть разложено на отдельные составляющие его элементы, которые при этом получаются в виде простых веществ. [11]
Число электронов у разных атомов различно. Оно определяется величиной заряда ядра. Заряд ядра всегда выражен целым числом; зная величину ядерного заряда, можно точно установить число электронов для каждого химического1 элемента. Из сказанного ясно, что порядковый номер указывает также число электронов для каждого элемента. Например, кислород стоит в периодической системе под номером 8, это значит, что атомное ядро кислорода несет на себе положительный заряд, равный 8, что вокруг ядра вращается 8 электронов. [12]
 |
Энергетические диаграммы образования молекул HF ( о и СО ( б. [13] |
Перекрывание АО двух разных атомов с образованием молекулы возможно только при близости их энергий, при этом АО атома большей электроотрицательности всегда на энергетической диаграмме располагаются ниже. [14]
Сравним скорости обмена разных атомов водорода в нафталине и дифениле с НВг со скоростью обмена водорода в бензоле. Отношение констант скорости обмена каждого из этих атомов к константе скорости обмена атомов водорода в бензоле называется фактором парциальной скорости. [15]
Страницы: 1 2 3 4