Простой атом
Cтраница 3
Некоторые системы, изучаемые в физике, представляют собой контраст по сравнению с относительно простым атомом. В таких системах взаимодействие частей необычайно сильно, в результате чего они проглатываются большей системой и частично или полностью теряют свою инивидуальность. Примером является ядро атома, которое обычно описывается как набор протонов и нейтронов. [31]
 |
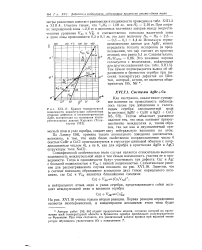
Электронные облака, соот - [ IMAGE ] Электронное облако, ветствующие состояниям Is ( а и соответствующее состоянию 2 / 7. [32] |
Естественно, что такое решение должно содержать много общего с решением задачи о простом атоме водорода. В частности, состояние электрона в атоме характеризуется заданием тех же трех квантовых чисел, что и состояние в атоме водорода. [33]
Но в высшей степени интересно то обстоятельство, что Дальтон выдвинул такие соображения о соединении простых атомов в сложные, которые привели к химической символике структурных формул и предвосхищают многие представления о структуре ряда сложных соединений, появившиеся полвека спустя. [34]
Естественно напрашивалась мысль, что сложный атом любой соли представляет единое целое всех входящих в него простых атомов. [35]
Далее Дальтон приводит атомные веса для сложных атомов, представляющие собой суммы атомных весов составляющих их простых атомов. Таким образом, в период 1807 - 1810 гг. ученый продолжал работать над дальнейшим совершенствованием своей атомной теории. [36]
Итак, Менделеев продолжает искать естественную причину того, почему сложный атом, образовавшийся из п одинаковых простых атомов, не будет весить ровно в п раз больше, чем один простой атом, иначе говоря, почему здесь не соблюдается принцип аддитивности и наблюдаются отклонения от целых чисел, выражающих арифметическую сумму весов исходных составных частей. Эту причину Менделеев усмотрел в том, что в момент образования сложного элемента из нескольких атомов более простого элемента ( как в предыдущем случае Pt из 4Fe), часть весомого вещества претерпевает качественное превращение, переходя в качественно иную форму, причем сам вес, по Менделееву, зависит от особого рода движения материи. Значит, при разложении сложного атома одного элемента на составляющие его более простые атомы другого элемента должно произойти обратное превращение такого же точно количества движения определенного вида в то движение материи, которое называется весом. [37]
При химических превращениях происходит или соединение простых атомов в сложные атомы, или разложение сложных атомов на простые атомы; при этом атомы не разрушаются и не образуются вновь. [38]
В этой формуле постоянные величины, обозначенные знаком функциональной зависимости г); перед скобкой, характеризуют простой атом ( заряд ядра, заряд электрона, массу электрона) и расстояние от ядра точки хуг для которой определяется г 5-функция. [39]
Соответствия между двумя теориями в приведенном выше случае не наблюдается, если рассматривать действительную скорость реакции двух простых атомов, соединяющихся друг с другом; до тех нор пока третье тело не примет освобождающуюся при образовании связи энергию ( если энергия но уходит в виде излучения), молекула всегда будет диссоциировать, и скорость реакции соединения будет равна нулю. [40]
 |
Кривая температурной зависимости концентрации собственных атомных дефектов в стехиометрическом AgBr, построенная на основании экспериментальных данных Курника ( Танн-хаузер. [41] |
Используя термодинамические данные для AgBr, можно определить теплоту испарения ( в предположении, что пар состоит из простых атомов); она равна 5 1 эв. [42]
Итак, квантовая механика с привлечением понятия о спине электрона позволяет точно описать все возможные состояния электрона в простом атоме. Три из них ( п, I и т) определяют энергию электрона и его электронное облако, четвертое ( s) - свойство электрона обладать спином. [43]
При этом оказывается, что наиболее удовлетворительной является формула Слетера - Кирквуда (2.51), которая дает хорошее согласие для простых атомов ( Не, Ыеипр. Лондона (2.50) приблизительно в 2 - 2 5 раза недооценивает дисперсионное притяжение, а формула (2.52) - несколько переоценивает его. Детальный анализ различных приближений дан в статье Сэйлема [84], где были предложены более сложные, но зато и более точные выражения. [44]
Шагом назад является то, что теория Дальтона не предусматривает сложных атомов ( молекул), состоящих из нескольких одинаковых простых атомов. Отказ от ломоносовской идеи о сложном составе и молекул простых веществ имел для химической атомистики поистине катастрофические последствия и возврат к ней - в виде опирающейся на опытные данные гипотезы Авогадро - осуществился лишь в результате многих десятилетий борьбы. [45]
Страницы: 1 2 3 4