Простой атом
Cтраница 2
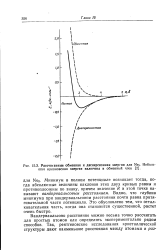 |
Рассчитанные обменная и дисперсионная энергии для Ne2. Небольшая кулоновская энергия включена в обменный член. [16] |
Вандерваальсово расстояние можно весьма точно рассчитать для простых атомов или определить экспериментально рядом способов. [17]
Дальтон, развивая представления о способах объединения простых атомов в сложные, преследовал лишь одну цель - создать теорию для объяснения эмпирически открытых стехиоме-трических законов. [18]
В сложном атоме, входящие в его состав простые атомы одного и того же вида отталкиваются друг от друга и соответственно этому занимают свои места. [19]
Указывая, что предвычисление этих сил как функций простых атомов нужно отложить до дальнейших исследований, Гульдберг и Вааге как первоочередную задачу рассматривают определение этих сил экспериментальным путем. Они считают, что в химии, как и в механике, наиболее естественным методом будет определение сил в их состоянии равновесия. [20]
Следовательно, признание химической неразложимости и механической неделимости простых атомов и их способности связываться между собой в различных соотношениях перекидывает еще один мост между макро - и микровеличинами в химии. [21]
Понятие о простом теле будет перенесено на понятие о простых атомах, а тело сложное будет составлено из нескольких различных простых атомов. [22]
Выяснили, что первые два слоя возможных состояний в простом атоме заполняются до предела электронами в атомах элементов соответственно первого и второго периодов, третий слой - в атомах элементов четвертого периода, четвертый слой максимально заполняется в шестом периоде. Остальные слои не завершены ни в одном из известных сейчас атомов. [23]
Правда, до сих пор мы были осторожны и ограничивались простыми атомами в простых молекулах. Теперь мы перейдем к многоэлектронным атомам и многоатомным молекулам, где справиться со стоящими перед нами задачами о природе химической связи будет необычайно трудно. В этих случаях химики используют приближенные методы, основанные на тех принципах, которые мы только что изложили, - на принципах, выведенных для более простых молекул. В следующей главе будет показано, как это делается. [24]
Так же как инертные газы составляют основу периодической таблицы, самый простой атом - атом водорода - дает ключ, который открывает доступ в эту систему. Атомы любого другого элемента подражают атому водорода. Для того чтобы убедиться, что это действительно так, мы должны исследовать взаимодействие атомов водорода со светом. Свет, испускаемый ( или поглощаемый) атомами водорода, называется спектром атомарного водорода. Этот спектр позволяет лучше понять сущность периодической таблицы. [25]
Как указывалось, уравнение Шредингера может быть точно решено лишь для простых атомов и молекулярного иона водорода. Для более сложных систем оно может быть решено только приближенно, причем приближенное решение даже для атомов с небольшим порядковым номером - трудоемкая математическая задача. [26]
Рассмотренный способ расчета уровней энергии стационарных состояний дает хорошие результаты для простых атомов начала периодической системы элементов. [27]
Приняв его, Дальтон сразу нашел бы твердую точку опоры для определения числа простых атомов в частице сложного вещества и тем самым двинул бы свою атомистику вперед. [28]
Позднее, в 1819 г., Берцелиус так писал о принципах определения чисел простых атомов в сложных соединениях, которыми он пользовался: Я старался определить число элементарных атомов в сложных телах и относительный вес атома каждого простого тела. [29]
Систематические экспериментальные исследования первичного распределения колебательной и вращательной энергий НС1 в реакциях обмена простым атомом выполнены при низких давлениях струевой разрядной методикой. В первом использованном методе I [118] скорость колебательной релаксации измерялась по спаду заселенности с расстоянием вдоль оси разрядной трубки большого диаметра, через которую при низких давлениях быстро пропускались продукты реакции. [30]
Страницы: 1 2 3 4