Доля - водородная связь
Cтраница 1
 |
Хроматограмма, полученная на колонке с раствором нитрата серебра в глико. [1] |
Доля водородной связи в общей энергии взаимодействия веществ уменьшается по мере роста их молекулярного веса. Поэтому, например, при разделении спиртов на диглицерине или полиэфирной смоле27 28 вначале элюируется этанол, а затем метанол. [2]
При этом доля водородных связей ( в интервале перехода) оказывается линейной функцией от обратной температуры. [3]
Для определения доли неразорванных водородных связей, а также относительной доли молекул, связанных посредством водородных связей с 1, 2, 3 и 4 ближайшим И соседями, были поставлены исследования по комбинационному рассеянию и инфракрасной спектроскопии. Эти исследования должны были также дать ответ на вопросы, существуют ли мономерные молекулы воды и могут ли водородные связи иметь разную энергию. Сложный характер взаимодействия между молекулами воды весьма затрудняет интерпретацию полученных спектров, поэтому разные исследователя приходят к противоречивым заключениям. [4]
Результаты этих измерений позволяют приблизительно оценить долю разорванных водородных связей при фазовом превращении, если исходить из величины теплоты разрыва водородной связи б 2ккал / моль для низкомолекулярных спиртов и учесть полную занятость гидроксильных групд в водородных связях ( в спектрах исходного полимера отсутствует полоса несвязанных гидроксильных групп) как в кристаллических, так и аморфных областях. [5]
В самом деле, в этом случае попытки определить долю разорванных водородных связей в жидкой воде с помощью различных экспериментальных и теоретических методов будут давать неопределенные или даже противоречивые ответы. В случае кривой а это происходит потому, что выражение разорванная связь не соответствует какой-либо строго определенной области на кривой энергии. Следовательно, в различных методах анализа свойств воды водородную связь можно рассматривать как разорванную, когда на кривой выбирают различные точки. Короче говоря, доля разорванных водородных связей в жидкости не является полезным параметром при описании воды. Ситуация становится еще менее ясной, когда энергия описывается кривой г и, по-видимому, в этом случае лучше все же говорить об искажении водородных связей. [6]
Два параметра являются общими для большинства этих исследований - энергия, необходимая для разрыва водородной связи, и доля разорванных водородных связей в жидкости при данной температуре. Мы найдем, что соответствующая интерпретация тепловой энергии воды может быть дана на основе разорванных водородных связей при условии, что математическая модель является достаточно гибкой в способе согласования параметров. [7]
Хеггис, Хастед и Буханан [30] на основании данных о зависимости диэлектрических свойств льда и воды от температуры вычислили долю разорванных водородных связей, а также относительную долю ( %) молекул, связанных с 4, 3, 2, 1 молекулой, и долю свободных молекул. Однако эти результаты находятся в явном противоречии с обсуждавшимися ранее данными рентгеновских исследований, которые указывают на увеличение координационного числа. [8]
Эта модель получила дальнейшее развитие в исследовании Хаглера, Шираги и Немети [676] при расчете функции распределения размеров кластеров и доли неразорванных водородных связей. Согласно расчету, средний состав кластера при 0 С равен 11 2 молекул. На основании этих результатов можно считать, что структурные модели, предполагающие одновременное существование воды в двух состояниях, неправильны. [9]
При температурах выше точки минимальной сжимаемости в воде, вероятно, практически нет роев, подобных по структуре льду-I, значительна доля разорванных водородных связей по сравнению с тем же льдом-1, и сжимаемость сильно зависит от ван-дер-ваальсового взаимодействия молекулярных комплексов. [10]
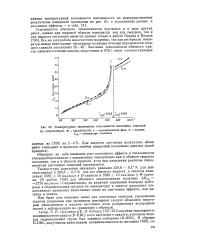 |
Температурная зависимость теплоемкости изотопных гликолей. [11] |
Как было уже показано выше для изотопных этанолов, уменьшение теплоты плавления при указанном замещении следует объяснять некоторым уменьшением в жидком состоянии доли разорванных водородных связей у дейтероспирта по сравнению с обычным. [12]
В рамках рассматриваемой модели, в которой переход инициируется разрывом водородных связей в любом месте цепи, эти взаимодействия углубляют минимум на кривой зависимости размеров макромолекулы от доли разорванных водородных связей. Если же переход инициируется только разрывом водородных связей на концах цепи, взаимодействия дальнего порядка приводят к тому, что размеры макромолекул проходят в процессе плавления через максимум, а не через минимум. [13]
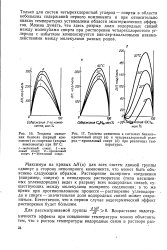 |
Теплоты смеше - [ IMAGE ] Теплоты смешения в системах бензол. [14] |
Только для систем четыреххлористый углерод - спирты в области небольших содержаний первого компонента и при относительно низких температурах установлены области экзотермических эффектов. Можно думать, что здесь разрыв доли водородных связей между молекулами спирта при растворении четыреххлористого углерода с избытком компенсируется ван-дер-ваальсовыми взаимодействиями между молекулами разных родов. [15]
Страницы: 1 2