Отрицательно заряженный атом - кислород
Cтраница 1
Отрицательно заряженный атом кислорода Ое обладает значительно более сильным электронодонорным эффектом ( /, М), нежели гидрокси-группа. [1]
Отрицательно заряженный атом кислорода карбоксилатной группы приближается с тыльной стороны по отношению к разрывающейся связи С-Br и выталкивает бромид-ион. По существу, первая медленная стадия этой реакции представляет собой внутримолекулярное нуклеофильное замещение 5 2 с образованием трехчленного цикла в переходном состоянии. [2]
Но отрицательно заряженный атом кислорода может находиться не только вблизи одного положитеяьно заряженного атома кремния соседней молекулы, но и между двумя положительно заряженными атомами кремния двух соседних молекул. В этом случае мы получаем структуру, изображенную на рис iD. Взаимодействующие атомы кремния трех молекул также образуют треугольник, но в этом случае его высоты совпадают с продолжениями высот взаимодействующих молекул-треугольников. Эта структура является структурой ( 3-кварца. Таким образом, если структура а-кварца объясняется тем, что отрицательно заряженный атом ки. [3]
Между отрицательно заряженным атомом кислорода и атомом углерода, имеющим значительный положительный заряд, осуществляется ион-дипольное взаимодействие. [4]
Причем между отрицательно заряженным атомом кислорода и атомом углерода с положительным зарядом имеет место ион-ди-гюльное взаимодействие; промежуточный неустойчивый продукт перегруппировывается. [5]
Расстояние между отрицательно заряженными атомами кислорода карбоксилатной группы и положительно заряженным атомом азота в N02 или М ( СН3) з равно 6 50 А, а эффективное расстояние между этими же атомами кислорода и атомами кислорода нитро-группы равно 7 45 А. Иными словами, в этом плане индукционное влияние заместителей через алициклический фрагмент не отличается от такового в чисто алифатических системах. [6]
На второй стадии пара электронов, принадлежащая отрицательно заряженному атому кислорода, атакует атом углерода, который в этот момент еще связан и с нуклеофильной, и с уходящей группами; наконец, эта пара электронов замещает уходящую группу. Эта последняя стадия аналогична Elcb-отщеплению. [7]
Известно, например, что в молекуле пенициллина отрицательно заряженные атомы кислорода и положительно заряженные атомы натрия группируются вокруг винтовых линий. [8]
Миграция арильного радикала осуществляется в результате выталкивающего влияния отрицательно заряженного атома кислорода. В остальном реакция аналогична перегруппировкам ионов карбония. Бензиловая перегруппировка может рассматриваться как непосредственная иллюстрация того, что карбонильная группа частично обладает характером иона карбония. [9]
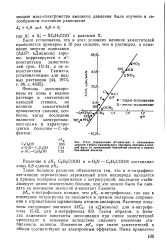 |
Корреляция а - констант с изменением энергии Гиббса равновесного переноса протона в газовой фазе от замещенной бензойной кислоты и аниону бензойной кислоты. [10] |
Такое большое различие объясняется тем, что в я-нитрофено-лят-анионе отрицательно заряженный атом кислорода находится в прямом полярном сопряжении с нитрогруппой; последняя стабилизирует анион значительно больше, чем это можно было бы ожидать на основании значений а-констант Гаммета. [11]
Льюиса, адсорбировавший воду; основной центр рассматривается как отрицательно заряженный атом кислорода. Необычный минимум кислотности при 600 С ( рис. 20), по-видимому, обусловлен низкой кристалличностью - ц - А1 203, что следует из данных рентгеновского анализа. [12]
Аминогруппа подвергается взаимокомпенсируемому влиянию электроноакцепторной карбонильной группы и элек-тронодонорного отрицательно заряженного атома кислорода, в результате чего, напр. Значение рН, при к-ром концентрация катионов А. [13]
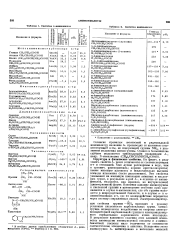 |
Свойстиа а-аминокислот.| Свойства аминокислот. [14] |
Аминогруппа подвергается воздействию со стороны электро-ноакцепторной карбонильной группы и электронодонор-ного отрицательно заряженного атома кислорода. В результате взаимного гашения этих влияний основность аминогрупп аминоуксусной кислоты и и-амино-бензойной кислоты мало отличается от основности соответственно этиламина и анилина. [15]
Страницы: 1 2 3 4