Отдельный углеродный атом
Cтраница 1
Отдельные углеродные атомы этих Сахаров нумеруют цифрами, начиная от карбонильной группы; таким образом, карбонильная группа глюкозы обозначается цифрой 1, фруктозы-2. Благодаря наличию в глюкозе 4 асимметрических атомов углерода, теория строения предусматривает 24, или Шстереоизомерныхформ, для фруктозы 23 или 8 стереоизомеров. В действительности же число стереоизомеров значительно больше, что объясняется способностью такого рода соединений, например глюкозы, существовать в виде спиртоокисных форм. [1]
Отдельные углеродные атомы простейших Сахаров обычно нумеруют арабскими цифрами, начиная со стороны карбонильной части молекулы. [2]
Величина электронной плотности отдельных углеродных атомов ароматического кольца, определяющаяся наличием заместителей в этом кольце, обусловливает как ориентацию вступающей интрогруппы в ядро, так и скорость этого процесса. Заместители в ядре ориентируют нитро-группу, влияя на направление передвижения NOj и степень стабильности образующегося переходного комплекса. [3]
С другой стороны, известно, что в пиридиниевом радикале отдельные углеродные атомы характеризуются неодинаковым характером распределения электронной плотности. [4]
Как показывают измерения ЯМР, различия в электронных плотностях у отдельных углеродных атомов основного состояния монозамещенного ароматического соединения не так велики, как следовало бы ожидать на основании эффекта сопряжения заместителей. Например, у хлор - и бромбензола, фенола и анизола не наблюдается вообще никаких различий. Следовательно, плотность электронов в нормальном состоянии ароматического соединения не может одна определять ориентацию заместителя при замещении. [5]
Как показывают измерения ядерного магнитного резонанса, различия в электронных плотностях у отдельных углеродных атомов основного состояния монозамещенного ароматического соединения не так велики, как это следовало бы ожидать-на основании мезомервого эффекта заместителей. Для хлор - н бромбенэолов, фенола и анизола, например, не наблюдается вообще никаких различий. Следовательно, только плотмость электронов в нормальном состоянии ароматического соединения не может обусловить ту или иную ориентацию заместителя при вторичном электрофнльном замещении. [6]
Тетрагидропроизводное фолиевой кислоты ( см. ниже) используется в качестве кофактора в биологическом синтезе, во время которого отдельные углеродные атомы подвергаются окислению или восстановлению и переносятся на молекулы субстрата в форме группы - СН3, - СНгОН или - СНО. [7]
Эти авторы пришли к выводу, что вряд ли значение разных путей можно оценить по той скорости, с которой отдельные углеродные атомы глюкозы появляются в виде С14О2, даже если известен выход всех шести углеродных атомов. Однако у нас еще слишком мало данных, чтобы решить вопрос, происходит ли в растениях рециркуляция гексозы по пентозофосфатному пути. [8]
Вследствие ингредиента концентраций образующихся при этом между гранями частиц никеля, на которых дегидрируется углеводородная молекула и отлагается углерод, и на гранях, где этих процессов не происходит, возникает диффузия углеродных дегидрированных цепочек или, вероятнее всего, отдельных углеродных атомов к противоположной грани. Атомы углерода, достигшие противоположной грани, вследствие своей активности образуют термически нестабильные карбидные соединения с поверхностными атомами никеля. Следующие порции углерода способствуют застройке кристаллической решетки образующихся поверхностных карбидов. [9]
В основном состоянии молекулы в данном случае в равной мере представлены все граничные структуры. Связи между отдельными углеродными атомами кольца всюду имеют одинаковую длину, энергия делокализации составляет 2 45 / 3 - 45 ккал / моль. Такое симметричное распределение заряда невозможно в анионе пиррола ввиду наличия гетероатома. Анион пиррола находится в таком же отношении к аниону циклопентадиенила, как пиридин к бензолу. [10]
Молекулы органических полимеров имеют сложную форму цепей или пространственных сеток, построенных в основном из атомов углерода. Что же происходит с органическими полимерами при нагревании. Отдельные углеродные атомы окисляются, при этом большая молекула полимера разрушается на отдельные маленькие осколки, которые окисляются еще быстрее, и в конечном итоге полимерная молекула перестает существовать - она превращается в не пригодные для использования продукты окисления. [11]
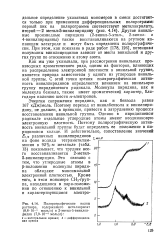 |
Полярографические волны раствора, содержащего метилакрилат ( 8 8 - 10 - 4 моль / л и 2-метил - 5-винилпи-ридин ( 7 9 - 10 - 4 моль / л. [12] |
Энергия сопряжения пиридина, как и бензола равна. Поэтому переход от винилбензола к винилпири-дину, не должен, в принципе, привести к затруднению процесса-восстановления винильной группы. Однако в пиридиниевом радикале отдельные углеродные атомы имеют неодинаковую электронную плотность. [13]
Повышение или понижение реакционной способности ароматических соединений ( влияние на легкость замещения), вызванное уже имеющимся в ядре заместителем, ничего не говорит о его влиянии на направление замещения. Объяснение правил ориентации, которое дается во многих учебниках, исходя из мезомерных предельных состояний монозамещенных ароматических соединений, предполагает, что заместители не только влияют на общую основность ядра в основном состоянии, но и у каждого углеродного атома ядра создают различные плотности электронов. Как показывают измерения ядерного магнитного резонанса, различия в электронных плотностях у отдельных углеродных атомов основного состояния монозамещенного ароматического соединения не так велики, как это следовало бы ожидать на основании мезомерного эффекта заместителей. У хлор - и бромбензола, фенола и анизола, например, не наблюдается вообще никаких различий. Следовательно, плотность электронов в нормальном состоянии ароматического соединения не может одна определять ориентацию заместителя при вторичном электрофильном замещении. Разные направления вторичного замещения объясняются тем, что заместители влияют на величину энергии активации реакций, ведущих к орто -, мета - и / шра-замещенным продуктам. Различие в энергиях активации для орто -, мета - и пара-заместителей основано на том, что разница энергий между основным и переходным состоянием AI ( см. рис. 91) у этих веществ существенно отличается. Так как энергия переходного состояния неизвестна, то вместо нее будет рассматриваться сг-комплекс ( В на рис. 91), который лежит вблизи переходного состояния. Неточность, связанная с этим упрощением, невелика. [14]
Повышение или понижение реакционной способности ароматических соединений ( влияние на легкость замещения), вызванное уже имеющимся в ядре заместителем, ничего не говорит о его влиянии на направление замещения. Объяснение правил ориентации, которое дается во многих учебниках, исходя из мезомерных предельных состояний монозамещенных ароматических соединений, предполагает, что заместители не только влияют на общую основность ядра в основном состоянии, но и у каждого углеродного атома ядра создают различные плотности электронов. Как показывают измерения ядерного магнитного резонанса, различия в электронных плотностях у отдельных углеродных атомов основного состояния монозамещенного ароматического соединения не так велики, как это следовало бы ожидать на основании мезомерного эффекта заместителей. У хлор - и бромбензола, фенола и анизола, например, не наблюдается вообще никаких различий. Следовательно, плотность электронов в нормальном состоянии ароматического соединения не может одна определять ориентацию заместителя при вторичном электрофильном замещении. Разные направления вторичного замещения объясняются тем, что заместители влияют на величину энергии активации реакций, ведущих к орто -, мета - и napa - замещенным продуктам. Различие в энергиях активации для орто -, мета - и пара-заместителей основано на том, что разница энергий между основным и переходным состоянием А4 ( см. рис. 91) у этих веществ существенно отличается. Так как энергия переходного состояния неизвестна, то вместо нее будет рассматриваться 0-комплекс ( В на рис. 91), который лежит вблизи переходного состояния. Неточность, связанная с этим упрощением, невелика. [15]
Страницы: 1 2