Первый атом - водород
Cтраница 3
Метод выбора значения энергии связи ОН для вышеприведенного расчета иллюстрирует различие между энергией связи и энергией диссоциации. Так, в то время как энергия связи ОН по уравнению ( 3) принята равной 110 ккал, энергия диссоциации для отрыва первого атома водорода от воды по уравнению ( 4) равна 120 ккал, а для отрыва второго атома по реакции ( 5) - 101 ккал. Хотя сумма энергий этих реакций равна сумме энергий связи ОН, первый атом водорода оторвать труднее, чем второй. Несколько иное положение наблюдается для перекиси водорода. Однако в обоих случаях выбранная выше энергия связи ОН больше, чем энергия диссоциации. Вероятно, это обусловлено образованием трехэлектронных связей в НО, и О. [31]
Таким образом, современные представления о механизме и кинетике гидрирования бензола, хотя и имеют определенные противоречия и неясности, приводят к ряду общепринятых основных выводов. К ним относятся обязательность геометрического соответствие структуры металла и ароматического соединения при плоскостной адсорбции, невозможность или трудность образования промежуточных продуктов, определение скорости процесса большею частью парциальным давлением водорода и, наконец, представление об образовании я-комплексов ароматического соединения с переходными металлами 22, причем присоединение первого атома водорода является лимитирующей стадией процесса в целом. [32]
Таким образом, современные представления о механизме и кинетике гидрирования бензола, хотя и имеют определенные противоречия и неясности, приводят к ряду общепринятых основных выводов. К ним относятся обязательность геометрического соответствия структуры металла и ароматического соединения при плоскостной адсорбции, невозможность или трудность образования промежуточных продуктов, определение скорости процесса большею частью парциальным давлением водорода и, наконец, представление об образовании я-комплексов ароматического соединения с переходными металлами 22, причем присоединение первого атома водорода является лимитирующей стадией процесса в целом. Все эти выводы сделаны в отношении гетерогенных катализаторов. [33]
Поверните книгу на 90 и смотрите на верхний или нижний наборы уровней. Рассмотрим сначала спектр СЩ-радикала. Первый атом водорода расщепляет резонансную линию на две, а второй расщепляет каждую из этих компонент еще па две. [34]
Здесь показаны три стадии процесса. Статистически вероятность разрыва связи С - Н в 2 раза больше вероятности разрыва связи С-С; кроме того, надо допустить, что значительная часть разорванных связей С-С возникает снова. Если первый атом водорода захватывает соседний атом Н той же цепи, то происходит образование двойной связи. Очевидно, этот механизм в различной степени применим и для сшивания других полимеров. [35]
Эта кислота не коагулирует белок. В водных растворах первый атом водорода практически полностью ионизирован. [36]
Известно большое число неорганических производных перекиси водорода, в том числе перекисей металлов и неметаллов, пероксокислот и их солей, которые все содержат кислород в так называемой активной или способной к выделению форме. Перекиси и пероксокислоты можно рассматривать как производные от Н2О2, получаемые замещением одного или обоих атомов водорода атомами металла или кислотными радикалами. Так, при замене первого атома водорода атомом натрия получается NaOOH ( гидроперекись натрия, термически малостойкое соединение); замещением обоих атомов водорода получают NaOONa или обыкновенную перекись натрия. [37]
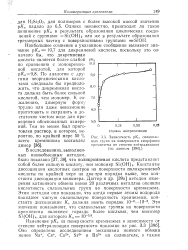 |
Зависимость рКа силанольных групп на поверхности аморфного кремнезема от степени нейтрализации ( по данным. [38] |
Этим методом они показали, что когда первые атомы водорода покидают чистую силанольную поверхность кремнезема, константа диссоциации К. [39]
Метод выбора значения энергии связи ОН для вышеприведенного расчета иллюстрирует различие между энергией связи и энергией диссоциации. Так, в то время как энергия связи ОН по уравнению ( 3) принята равной 110 ккал, энергия диссоциации для отрыва первого атома водорода от воды по уравнению ( 4) равна 120 ккал, а для отрыва второго атома по реакции ( 5) - 101 ккал. Хотя сумма энергий этих реакций равна сумме энергий связи ОН, первый атом водорода оторвать труднее, чем второй. Несколько иное положение наблюдается для перекиси водорода. Однако в обоих случаях выбранная выше энергия связи ОН больше, чем энергия диссоциации. Вероятно, это обусловлено образованием трехэлектронных связей в НО, и О. [40]
Если та или иная молекула содержит несколько тождественных связей, то энергии их сами по себе одинаковы. Например, разложение молекул воды по суммарной схеме НОН Н О Н требует затраты 221 ккал / моль, что соответствует средней энергии связи Н - О, равной 110 5 ккал / моль. Однако при последовательном разложении по схемам НОН Н ОН и ОН О Н затраты энергии уже различны: отрыв первого атома водорода требует 119 ккал / моль, а второго - 102 ккал / моль. [41]
Если та или иная молекула содержит несколько тождественных связей, то энергии их сами по себе одинаковы. Например, разложение молекул воды по суммарной схеме НОН Н О Н требует затраты 221 ккал / моль, что соответствует средней энергии связи Н - О, равной 110 5 ккал / моль. Однако при последовательном разложении по схемам НОН Н ОН и ОН О Н затраты энергии уже различны: отрыв первого атома водорода требует 119 ккал / моль, а второго - 102 ккал / моль. [42]
Если молекула содержит несколько тождественных связей, то энергии их сами по себе одинаковы. Например, разложение молекул воды по суммарной схеме НОН Н О - f - H требует затраты 924 кДж / моль, что соответствует средней энергии связи О - Н, равной 462 кДж / моль. Однако при последовательном разложении по схемам НОН НО Н и ОН О Н затраты энергии уже различны: отрыв первого атома водорода требует 497, а второго - 427 кДж / моль. [43]
Для средних величин связей правила аддитивности энергии связей удовлетворяются неплохо. Однако для кинетики важны не средние величины энергий связей, определяемые из термохимических данных. Например, при разложении мотана или этана на элементы важно не то, что средняя энергия связи О. Для кинетики интересно, какую энергию надо затратить на отрыв от молекулы одного первого атома водорода. Особенно же сильно отличается энергия разрыва связи С - Н в молекуле. Это в основном определяется том, что электронная плотность распределена между связями неравномерно. В одних связях она больше, чем это отвечает классической картине двух электронов, в других - меньше. Если данная связь имеет меньшую электронную плотность валентных электронов, то разрыв связи облегчается. Чем легче связь разрывается, тем активнее молекула. Таким образом, правило Воеводского получает естественное объяснение. Конечно, нельзя его применять для сравнения активности радикалов совершенно различного химического состава, например, если один радикал получается путем разрыва связи С - Н в молекуле, а другой путем разрыва связи С-С в той же молекуле. В этом случае энергии разрыва разных связей будут различными и для классической картины электронов, закрепленных попарно на связь, и не могут характеризовать активность получаемых радикалов. [44]
Тот факт, что присоединение водорода также происходит с менее затрудненной стороны, указывает, что, по-видимому, водород, прежде чем прореагировать с олефином, тоже адсорбируется на поверхности катализатора. Вероятно, что при адсорбции молекула водорода расщепляется на атомы. На второй стадии один из адсорбированных атомов водорода соединяется с атомом углерода, в результате чего образуется ал-кильный радикал ( который остается связанным с поверхностью катализатора, но теперь уже только одной связью) и освобождаются два реакционных центра на катализаторе. Наконец, второй атом водорода ( необязательно тот, который был ранее связан с первым атомом водорода) взаимодействует с радикалом, давая продукт реакции, освобождающийся с поверхности катализатора, и при этом вакантными становятся еще два реакционных центра на поверхности. [45]
Страницы: 1 2 3 4