Более сложный атом
Cтраница 1
Более сложные атомы имеют все большее и большее количество протонов я нейтронов в ядре наряду с соответствующим увеличением планетарных электронов. [1]
Для более сложных атомов с несколькими электронами необходимо учесть энергию отталкивания всех электрюнов. [2]
Для более сложных атомов с несколькими электронами необходимо учесть энергию отталкивания всех электронов. [3]
Для более сложных атомов с несколькими электронами необходимо учесть энергию отталкивания всех электрюнов. [4]
Схемы более сложных атомов в VII классе не рассматривают. [5]
Спектры более сложных атомов описываются атомной моделью Бора неудовлетворительно. Хотя модель Бора была существенно улучшена, прежде всего 3 о м м е р-ф е л ь д о м, фактически невозможно охватить ею все тонкости строения атома. Не удается объяснить и образование молекул из атомов. [6]
В более сложных атомах только наиболее удаленные от ядра электроны способны принимать участие в образовании таких связующих пар. Они называются валентными, так как их числом определяется валентность атома. [7]
В более сложных атомах поле других электронов экранирует поле ядра, поэтому по мере удаления от ядра потенциал убывает быстрее, чем в атоме водорода. Поэтому энергия валентных электронов тем меньше ( или энергия связи тем больше), чем ближе данная орбита подходит к ядру. [8]
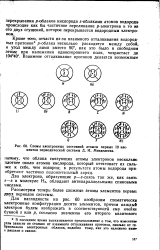 |
Схемы электронных состояний атомов первых 10 элементов периодической системы Д. И. Менделеева. [9] |
Рассмотрим теперы более сложные атомы элементов первых двух периодов системы. [10]
Хотя для более сложных атомов точное решение волнового уравнения невозможно, результаты, полученные для атома водорода, могут быть распространены и на такие системы при введении некоторых изменений. [11]
Исследование спектров более сложных атомов показало, что частоты линий их излучения также представляются в виде разностей спектральных термов, характерных для данного атома, но формулы для термов бывают несколько сложнее, чем формула (13.6) для атома водорода. [12]
В спектральных сериях более сложных атомов взаимодействие между наружными, или оптическими, электронами и ядром ослабляется за счет экранирования электронами, расположенными ближе к ядру. Поэтому здесь простой закономерности в серии спектральных линий уже не получается. [13]
Состояния электронов в более сложных атомах, содержащих несколько электронов, характеризуются таким же набором квантовых чисел, что и у атома водорода. Однако здесь энергия электрона зависит не только от главного квантового числа п, характеризующего размер электронного облака в данном состоянии, но и от других квантовых чисел, характеризующих пространственную конфигурацию этого облака. [14]
Оказалось, что для более сложных атомов, даже для атома гелия, количественные расчеты по теории Бора не приводят к такому согласию с экспериментальными данными, как для атома водорода и подобных ему систем. Да и для водородного атома теория Бора, хорошо характеризуя положение линий в спектре, не могла объяснить причину их различной интенсивности и некоторых других особенностей. [15]
Страницы: 1 2 3 4