Центральный атом - хлор
Cтраница 1
Центральный атом хлора находится в состоянии р3 - гибридизации. [1]
Центральный атом хлора имеет несвязывающую электронную пару и один неспаренный электрон, который оказывает существенное влияние на свойства этого оксида хлора. [2]
Центральный атом хлора находится в состоянии 5 / 03-гидридизацни. С уменьшением числа неподеленных электронных пар искаженность тетраэдра уменьшается и ClOj, у которого отсутствуют неподеленные электронные пары центрального атома хлора, уже представляет собой правильный тетраэдр. В ряду СЮ - - - СЮ3 - - - СЮз - - С1С7 возрастает роль я-связывания, вследствие чего закономерно уменьшается dc - o и увеличивается прочность связи кислорода с хлором. И структурные, и энергетические факторы приводят к стабилизации оксоанионов в указанном ряду и одновременному падению их окислительной активности. Увеличение силы кислоты в обсуждаемом ряду обусловлено тем, что с ростом числа кислородных атомов электронные облака все больше стянуты к центральному атому и связь Н - О делается все более ионной. [3]
Центральный атом хлора находится в состоянии р3 - гибридизации. [4]
 |
Структура димера хлорида алюминия ( А1С13 2 ( г. Каждый атом алюминия связан с четырьмя атомами хлора. [5] |
И в этой системе центральный атом хлора эквивалентно связан не с одним, а с двумя атомами алюминия. [6]
СЮ, у которого отсутствуют неподеленные электронные пары центрального атома хлора, уже представляет собой правильный тетраэдр. [7]
В этом ряду увеличивается число атомов кислорода, связанных с центральным атомом хлора. [8]
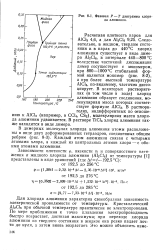 |
Фазовая Р - Т диаграмма хлорида алюминия. [9] |
Каждый атом алюминия связан с четырьмя атомами хлора, а каждый из центральных атомов хлора - с обоими атомами алюминия. [10]
Химически перхлорилфторид весьма инертен, что хорошо согласуется с его симметричной структурой с валентно и координационно насыщенным центральным атомом хлора. [11]
С - С1 - С1 либо 90, либо 120, что обусловлено 5р3й - гибридизацией центрального атома хлора, предложен как вероятный источник продукта присоединения в связи с тем, что структурно он построен таким образом, что при распаде образуется цыс-дихлорид. [12]
В той или иной степени способны к дисмутации и кислоты: хлорноватистая НС1О, хлористая НСЮ2 и хлорноватая НСЮз - Они как бы проявляют стремление к наибольшей симметрии молекулярного строения: самой симметричной формой обладает хлорная кислота НСЮ4, в молекуле которой центральный атом хлора окружен четырьмя атомами кислорода, расположенными по вершинам тетраэдра. [13]
Этим простым правилом рекомендуется пользоваться при выводе формулы ангидрида из формулы кислоты вместо чисто арифметического подхода, при котором значительно возрастает вероятность ошибки. Так, в НСЮ4 центральный атом хлора семивалентен, что соответствует ангидриду СЬО. [14]
При хлорировании влияние, оказываемое сопряжением на переходное состояние, столь значительно, что, по-видимому, потребуется предположить существование в переходном состоянии чего-то вроде полной а-связи между ароматическим кольцом и галогеном. Структура III аналогична структуре трихлорид-иона IV, в которой октет электронов у центрального атома хлора расширен. [15]
Страницы: 1 2