Водородный атом - метиленовая группа
Cтраница 2
Первым этапом синтеза веронала является получение ди-этилмалонового эфира. Водородные атомы метиленовой группы малонового эфира, располагающиеся между двумя карбонильными группами, могут замещаться последовательно атомами натрия, а затем на их место вводят два этильных радикала, с превращением малонового эфира в диэтилмалоновый эфир. [16]
Увеличение длины алкильных радикалов концевых алкоксиль-ных и ацильных групп практически не влияет на кинетику поглощения кислорода. Очевидно, водородные атомы метиленовых групп гликолей и дикарбоновых кислот, находящиеся между высокополярными сложноэфирными группами, в большей мере подвержены действию кислорода, чем водородные атомы концевых радикалов. У смешанных полиэфирных пластификаторов скорость поглощения кислорода имеет аддитивный характер. [18]
Фенилуксусная кислота получается из хлористого бензила через нитрил. Благодаря подвижности водородных атомов метиленовой группы легко вступает в различные реакции конденсации. Эта кислота и ее эфиры находят применение в парфюмерии. [19]
Фенилуксусная кислота получается из хлористого бензила через нитрил. Благодаря подвижности водородных атомов метиленовой группы легко вступает в различные реакции конденсации. Эта кислота и ее эфи-ры находят применение в парфюмерии. [20]
Фенилуксусная кислота получается из хлористого бензила через нитрил или через Mg-органические соединения. Благодаря подвижности водородных атомов метиленовой группы легко вступает в реакции конденсации. Эта кислота и ее эфиры применяются в парфюмерии. [21]
Соединения, содержащие карбонильные группы в р-положенииг проявляют особые свойства. Например, в молекуле ацетилацетона, или пентандион-2 4 ( р-дикетон) СН3 - СО-СН2-СО-СНз, водородные атомы метиленовой группы, находящейся между двумя кар-бонилами, обладают повышенной подвижностью. [22]
Явление енолизации представляет собой еще один пример общей зависимости. Объясняется это тем, что введение второго тригопального атома углерода в структуру циклонентана приводит к сдвигу водородных атомов соседних метиленовых групп в сторону от заслоненной ( гош) конфигурации, тогда как в случае циклогек-сановых систем справедливо как раз обратное положение. Таким образом, различие в устойчивости связано с различием в энергии напряжения обоих кетонов, причем делается допущение, что различием в устойчивости систем циклопентена и циклогексена можно пренебречь. В оправдание этого допущения указывается, что инкремент в теплотах образования между циклопентеном и циклогексеном составляет 9 3 ккал / молъ по сравнению с инкрементом в 11 ккал / молъ между циклопентаном и циклогексаном. Эти цифры следует сравнить с инкрементом, равным 4 9ккал на метиленовую группу в ряду алка-нов. Таким образом, напряжение, которое можно было бы ожидать в циклопентенах, не очень значительно. [23]
Энергию примыкающих к двойной простых связей определяли с использованием полученных выше теплот образования радикалов и теплот образования различных алкенов. При расчете было допущено, что двойная связь не оказывает заметного влияния на алкильные радикалы, замещающие водородные атомы метиленовой группы двойной связи. [24]
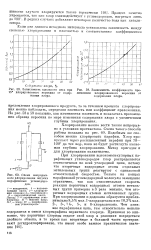 |
Зависимость коэффициента преломления хлорированного керосина от содержания хлора.| Схема непрерывного хлорирования жидких парафиновых углеводородов. [25] |
При хлорировании высокомолекулярных парафиновых углеводородов хлор распределяется статистически по всей углеродной цепи, потому что вторичные водородные атомы отдельных метиленовых групп реагируют с одинаковой относительной скоростью. Только на концах парафиновой углеводородной молекулы замещение ограничено, так как относительная скорость реакции первичных водородных атомов метиль-ных групп примерно в 3 раза меньше, чем вторичных водородных атомов метиленовых групп. При хлорировании м-додекана образуется приблизительно 8 5 % мол. [26]
При хлорировании высокомолекулярных парафиновых углеводородов хлор распределяется статистически по всей углеродной цепи, потому что вторичные водородные атомы отдельных метилоновых групп реагируют с одинаковой относительной скоростью. Только на концах парафиновой углеводородной молекулы замещение ограничено, так как относительная скорость реакции первичных водородных атомов метиль-ных групп примерно в 3 раза меньше, чем вторичных водородных атомов метиленовых групп. При хлорировании / - додекана образуется приблизительно 8 5 % мол. [28]
С двухвалентной медью аминокислоты образуют кристаллические, окрашенные в синий цвет комплексы, в которых метиленовая группа проявляет повышенную активность. Причина ее активности заключается в том, что аминогруппа за счет неподеленной пары электронов образует координационную связь с ионом двухвалентной меди, становится в известной мере электро-ноакцепторным заместителем и тем самым увеличивает подвижность водородных атомов метиленовой группы. [29]
При этом должна получаться смесь молекул цис-аконитовых кислот, меченных 14С по любой из двух крайних карбоксильных групп. Можно видеть, однако, что лимонная кислота является про-хиральной молекулой, которую для удобства можно изобразить следующим образом: С ( СН2СО2Н) 2 ( ОН) СО2Н, где хорошо видны все заместители у центрального атома углерода. При адсорбции молекул лимонной кислоты на ферменте ( аконитаза) происходит дифференциация между двумя химически эквивалентными группами СН2СО2Н, в результате чего дегидратация будет осуществляться исключительно в одном направлении. Следует отметить, что группы - СН2 также являются прохи-ральными центрами и образование цыс-аконитовой кислоты из лимонной под действием аконитазы будет осуществляться со специфическим отщеплением одного из двух водородных атомов соответствующей метиленовой группы. [30]
Страницы: 1 2 3