Более легкий атом
Cтраница 3
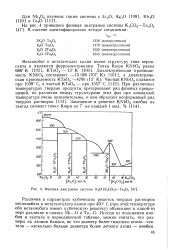 |
Фазовая диаграмма системы К2О ( К2СО3 - Та2С5. [31] |
Различия в параметрах кубических решеток твердых растворов метаниобата и метатанталата калия при 450 С ( при этой температуре оба метаниобата имеют кубическую решетку) объясняют в какой-то мере различие в связях Nb-О и Та-О. Исходя из положения ниобия и тантала в периодической таблице, можно считать, что размеры их атомов близки, но что диаметр более тяжелого атома-тантала - несколько больше диаметра более легкого атома - ниобия. [32]
Причина периодичности периферических свойств заключается в том, что число электронов, которые могут разместиться на разных энергетических уровнях, ограничено. Па мере роста порядкового номера новые электроны, заполнив все возможные места на более низких уровнях, начинают заполнять следующие более высокие уровни, повторяя последовательность заполнения более низких уровней и структуру внешней оболочки более легких атомов. Том сон ( 1897), ее детально исследовал Бор ( 1922), но лишь принцип Паули дал ей правильное толкование. [33]
Если структура содержит атом, обладающий сравнительно высоким атомным номером, то рентгеновское рассеяние будет в значительной степени обусловлено этим атомом. Для центро-симметричного случая последнее означает, что знак любой структурной амплитуды, вероятно ( хотя и не обязательно), будет определяться только тяжелым атомом. Если в этом приближении определятся положения других, более легких атомов, процесс уточнения может быть проведен дальше, как это было объяснено ранее. Тогда все ( или почти все) знаки могут быть взяты положительными, и ряд Фурье непосредственно приводит к определению абсолютной структуры, для которой заранее не было высказано никаких химических соображений. [34]
Однако из осторожности распределение электронной плотности первого приближения было рассчитано, исходя из учета координат одного только атома Ni. Результат расчета проекции XY изображен на рис. 150, а. Распределение плотности второго приближения ясно указывает на существование еще более легких атомов в точках А, В и С. [35]
Тогда, если / i - ffe / - нечетное число, лучи, рассеянные центральным атомом, будут отличаться по фазе ровно на 180 от лучей, рассеянных угловым атомом. Если бы оба атома были одинаковы, соответствующие рефлексы ( hkl) - Совершенно отсутствовали ( см. стр. Если же атомы различны, интенсивность луча, рассеянного более легким атомом, меньше, чем рассеянного более тяжелым, и, следовательно, оба луча даже в противоположных фазах будут различаться по амплитуде. Рефлексы ( hkl), для которых / г / е / - нечетное число, будут иметь меньшую интенсивность, но полностью не исчезнут. [36]
Оказалось, что считавшиеся неизменными атомы вещества на самом деле распадаются и лучи представляют собою летящие во все стороны осколки. Радий распадается на тяжелые атомы радиоактивного элемента радона и на более легкие атомы гелия, летящие с громадной скоростью пятнадцати тысяч километров в секунду и получившие название альфа-лучей. [37]
 |
Относительные интенсивности пиков изотопных ионов. [38] |
Уменьшение указанных отношений особенно заметно в случае иодсодержащих соединений, поскольку один атом Ш1 по массе соответствует большому числу более легких атомов. Хлор ( МС1 и ЭТС1; 3: 1) и бром ( Вг и 81Вг; 1: 1) имеют очень высокую естественную концентрацию тяжелых изотопов, что приводит к чрезвычайно характерному распределению интенсивностей в кластерах пиков, соответствующих галогенсодержащим ионам. Что касается молекулярных пиков, то в присутствии атомов хлора или брома резко возрастает интенсивность пиков m / z ( M 2) и ( М 4), в то время как на отношение интенсивностей ( М D / M эти галогены не влияют и оно по-прежнему отражает содержание С, Н, N и О. [39]
Если фазы атома металла корректны только для тех отражений, чьи интенсивности определяются исключительно рассеянием на атоме металла, рассчитанная фурье-карта будет показывать атом металла и ничего более, и расчет оказывается неудачным. Это необычный результат, но следует хорошо представлять себе, что при определении карты электронной плотности в описанной процедуре основной вклад дают наибольшие F0; для корректности фаз важнее всего те F0, в которые дают большие вклады легкие атомы структуры. Если для расчета карты используются лишь те отражения, для которых Fcalc ( металл) & 0 3Fobs, то, вероятно, на карте будут видны плотности более легких атомов. [40]
 |
Химические сдвиги 13С для гало еналканов. [41] |
При последующем замещении этот эффект выражен в еще большей степени. Подобный эффект наблюдается также при введении нескольких атомов брома. При введении более легких атомов хлора дополнительного смещения в сильное поле не происходит; напротив, в этом случае наблюдается смещение в слабое поле, обусловленное индукционным эффектом. [42]
К сожалению, как указывает Жигер 180 ], данные, на которых основаны рассуждения Уолта, не выдерживают критики. Как показывает приведенное выше обсуждение структуры перекиси водорода, значения для длины связи ОН и силовой постоянной, принятые Уолшем, были ошибочными. Меньшую энергию связи ОО, а также связей FF и NN по сравнению с энергиями для более тяжелых атомов можно легко объяснить. Вкратце этообъяснение состоит в том, что у более тяжелых атомов отталкивание внутренних оболочек снижает перекрывание орбит и энергию связи; для более легких атомов возможно большее сближение и образование более прочных связей, за исключением азота, кислорода и фтора, у которых отталкивание сильно сближенных заполненных орбит ограничивает прочность связи. [43]
 |
Образование а-орбиталей Я - Орбиталями. Аналогичный. [44] |
Рассмотрим теперь заполнение МО электронами. У молекул СО, N2 и аниона CN - имеется по 10 валентных электронов. Таким образом, в этих молекулах тройная связь ( одна а - и две я-связи), а л-электроны, занимающие орбиталь ап, являются донорами. Орбиталь зп практически совпадает с sP - орбиталью более легкого атома; следовательно, в молекуле СО и в анионе CN - можно считать ст-донорной электронную пару, локализованную на атоме углерода. [45]
Страницы: 1 2 3 4