Мостиковый атом
Cтраница 2
Отметим, что мостиковый атом кислорода в ионе SijOy окружен не тремя, а только двумя неподеленными электронными парами. [16]
 |
Элементы структуры Мо03. [17] |
Связи Мо с мостиковыми атомами О имеют длину 1 87 0 01 А, с концевыми - 1 73 А. [18]
Связи Ru с мостиковыми атомами Вг отличаются от связей Ru - - Вгконц. Авторы полагают, что причиной является гранс-лабил-изация связи Ru-Вг ОНц. Как видно из изложенного, для такой точки зрения мало оснований. Неясно также, почему транс-эффект должен влиять на Ru-Вгконц, и не должен влиять на Ru-Вгмост. [19]
Комплексные соединения с мостиковыми атомами кислорода называются оксоловылш. Одной из групп многоядерных оксоловых комплексов являются поликислоты. [20]
Комплексные соединения с мостиковыми атомами кислорода называются оксоловыми. Одной из групп многоядерных оксоловых комплексов являются поликислоты. [21]
Вследствие того, что мостиковый атом азота является донором трех электронов, может происходить замещение трех мостиковых СО-групп на два атома азота; при этом электронная конфигурация атомов металла остается неизменной. Следует отметить, что наиболее короткие расстояния Fe-Fe найдены в молекулах, где присутствует один или несколько мостиковых атомов азота. [22]
В этом переходном состоянии мостиковые атомы галогена расположены вне плоскости рисунка. [23]
Между тем распределение четырех мостиковых атомов ( 2Y и 2 Z) в каждом фрагменте четырехугольного паркета может быть чисто статистическим. Прямоугольная форма паркета будет при этом искажена, и в слое XYZ возможны отклонения от копланарного расположения атомов, но электрические свойства слоя ( диэлектричность или проводимость), по-видимому, не изменятся. [24]
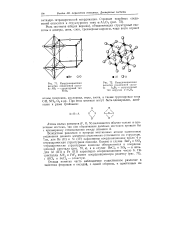 |
Координационная решетка соединений состава АВ3 - структурный тип Re03.| Координационная решетка соединений состава А2В3 - структурный тип корунда x - Al2O. t. [25] |
Вследствие различия в природе мостиковых атомов однотипные соединения данного элемента существенно отличаются по структуре. Так, для Be ( II) и Si ( IV) характерны координационное число 4 и тетраэдрическая структурная единица. Однако в случае BeF2 и SiO2 тетраэдрические структурные единицы объединяются в координационный кристалл ( рис. 70, в), а в случае ВеС12 и SiSa - в цепь. Но кристаллы A1F3 и FeF3 имеют координационную решетку ( рис. 71), 1 А1С13 и FeCls - слоистую. [26]
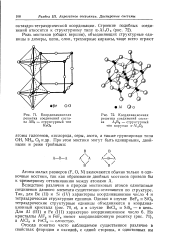 |
Координационная решетка соединений состава АВз - структурный тип ReO3.| Координационная решетка соединений состава А2В3 - структурный тип корунда а - А12О3. [27] |
Вследствие различия в природе мостиковых атомов однотипные соединения данного элемента существенно отличаются по структуре. Так, для Be ( II) и Si ( IV) характерны координационное число 4 и тетраэдрическая структурная единица. Однако в случае BeF2 и SiO2 тетраэдрические структурные единицы объединяются в координационный кристалл ( рис. 70, в), а в случае ВеС12 и SiS2 - в цепь. Но кристаллы A1F3 и FeF3 имеют координационную решетку ( рис. 71), а А1С13 и FeCl8 - слоистую. [28]
Вследствие различия в природе мостиковых атомов однотипные соединения данного элемента существенно отличаются по структуре. Отсюда понятно часто наблюдаемое существенное различие в свойствах оксидов и фторидов с одной стороны и однотипных им сульфидов и хлоридов - с другой. Например, BeF2 и SiO2, A1F3 и FeF3 тугоплавки, в воде не растворяются, химически неактивны, тогда как температуры плавления у ВеС12 и SiS2, A1C13 и FeCl3 значительно ниже, растворимость в воде и химическая активность высокая. [29]
Вследствие различия в природе мостиковых атомов однотипные соединения данного элемента существенно отличаются по структуре. Так, для Be ( II) и Si ( IV) характерны координационное число 4 и тетраэдрическая структурная единица. Однако в случае BeF2 и 8Ю2 тетраэдрические структурные единицы объединяются в координационный кристалл ( рис. 69, Б), а в случае ВеС12 и SiS2 - в цепь. [30]
Страницы: 1 2 3 4