Молярная доля - вещество
Cтраница 1
Молярная доля вещества / в смеси равна отношению парциального давления вещества / к общему давлению смеси. [1]
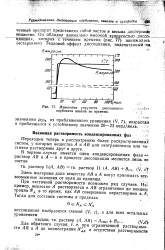 |
Изменение упругости диссоциации iTi. [2] |
Здесь молярные доли вещества АВ к А могут принимать всевозможные значения от нуля до единицы. [3]
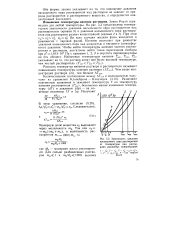 |
Зависимость давления насыщенного пара растворителя от температуры над растворами различных концентраций. [4] |
Молярную долю вещества хв выражают через моляльность тв. [5]
Как определить молярную долю вещества, если известны молярные доли двух других веществ раствора. [6]
L и V - молярные доли вещества соответственно в жидкой и паровой фазах при различных р и t ( L V 1); Ki yiJXi - константа равновесия t - ro компонента ( функции р, t) и состава. [7]
 |
Кинетические диаграммы состав-свойство. [8] |
При равновесии каждому значению молярной доли веществ А и В соответствует одно определенное значение некоторого свойства. Однако мы должны различать случаи, когда равновесие устанавливается сразу и когда оно устанавливается постепенно. В первом случае диаграмма составов изображена на рис. 61, а. Именно такие случаи мгновенного или установившегося равновесия и рассматриваются в физико-химическом анализе. Если, однако, вещества А и В реагируют не сразу, а с конечной скоростью, то в первый момент, пока нет АВ, на диаграмме рис. 61 6 не будет никакого максимума на месте АВ, а поблизости будет минимум аналогично промежуткам между А и АВ и АВ и В на рис. 61, в. [9]
Там они получались для предельного случая малой молярной доли лимитирующего вещества, когда влияние стефановского потока мало. [10]
Но этот простой результат справедлив только при малой молярной доле лимитирующего вещества; в противном случае подобие искажается стефановским потоком. [11]
Поскольку состав системы откладывается по оси абсцисс в молярных долях веществ А и В, отношения ( 71) равны отношению числа молей веществ А и В, образующих химическое соединение АпВт к числу молей веществ А и В, образующих расплав. [12]
Изобразим ее на графике для раствора компонентов А и В, откладывая по оси абсцисс молярную долю вещества В. [13]
 |
Эталонные образцы МакРейнольдса и их параметры. [14] |
Необходимость корректировки вызвана тем, что любая система оценки взаимодействий, имеющих место в неких растворителях, должна быть скорее связана с отношением молярных долей вещества, нежели с отношением его концентраций в жидкой и газовой фазе. [15]
Страницы: 1 2