Молярная доля - вещество
Cтраница 2
Повышенная растворимость в свою очередь служит указанием на образование водородной связи между веществом и растворителем. Сравнивая молярные доли вещества, насыщающие электронодонор-ные растворители при одном и том же парциальном давлении и температуре, с теоретически вычисленными из закона Рауля, можно судить о способности электронодонорного атома растворителя к образованию водородной связи. [16]
Повыщенная растворимость, в свою очередь, служит указанием на образование водородной связи между веществом и растворителем. Сравнивая молярные доли вещества, насыщающие электронодонор-ные растворители при одном и том же парциальном давлении и температуре, с теоретически вычисленными из закона Рауля, можно судить о способности электронодонорного атома растворителя к образованию водородной связи. [17]
Среди указанных функций некоторые могут быть зависимыми от остальных. Число зависимых функций определяет число ограничений на изменения молярных долей неподвижных веществ. [18]
Интересна работа Ли [6], в которой исследуется гетерогенная система с химическими реакциями. Такие соотношения автором называются невариантными и являются ограничениями на молярные доли веществ в какой-то одной фазе. [19]
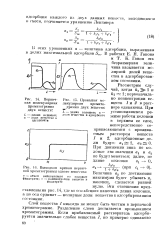 |
Промытая молекулярная хромато -. грамма двух веществ.| Выходная кривая первичной хроматограммы одного вещества. [20] |
Эти отношения представлены на рис. 14, где по оси абсцисс нанесена длина колонки, а по оси ординат - молярные доли вещества в адсорбированном состоянии. [21]
Если при элементарных преобразованиях этой матрицы эти величины не удается исключить, то их значения могут повлиять на ранг МХу. Во-вторых, даже когда учтены стехиометрические соотношения молярных долей, результат вычисления ранга в ряде случаев зависит от численных значений молярных долей неподвижных веществ. [22]
Если силовые поля молекул А и В одинаковы, то будут одинаковыми взаимодействия молекул А-А, А-В и В-В и число молекул, переходящих в пар, уменьшится пропорционально понижению молярной доли вещества А в растворе. [23]
Идеальные растворы в газо-жидкостной хроматографии встречаются редко, так как для обеспечения нелетучести жидкой фазы необходимы различия в полярности анализируемого вещества и растворителя или резко выраженные различия в их молекулярных объемах. Однако в газо-жидкостной хроматографии обычно применяются растворы достаточно разбавленные для того, чтобы к ним можно было применить закон Генри. Согласно этому закону парциальное давление компонента в разбавленном растворе пропорционально молярной доле вещества в жидкой фазе ( гл. [24]
Изобразим ее на графике для раствора компонентов А и В, откладывая по оси абсцисс молярную долю вещества В. Все линии этого рисунка являются прямыми, так как аналитические выражения парциального и общего давления насыщенного пара над раствором являются уравнениями первой степени относительно молярной доли вещества В. [25]
Уменьшение давления пара связано с уменьшением молярной доли жидкости А от 1 до -, что приводит к уменьшению числа молекул А, переходящих в пар. Так как силы взаимодействия молекул / ГА А, РЪ-ъ А-В одинаковы, то число молекул, переходящих в пар, уменьшится пропорционально понижению молярной доли вещества А в растворе. [26]
Так как Э1 о является общим свойством таких систем, то пунктирная линия, характеризующая расположение точек кипения и состава бинарных азеотропных смесей этилового спирта и вышеперечисленных парафиновых углеводородов, может быть использована для определения точек кипения и состава бинарных азеотропных смесей этилового спирта с другими парафиновыми углеводородами, для которых известны температуры кипения, но неизвестен состав образующейся азеотропной смеси. Следует отметить, что точки для других углеводородов располагаются над линией для парафиновых углеводородов примерно в следующем порядке: циклопарафины, моноолефины, диолефины и ароматические углеводороды. Из этого следует, что с данным, образующим азеотропную смесь веществом, все углеводороды, имеющие примерно одинаковую точку кипения, будут образовывать азео-тропные смеси, имеющие приблизительно одинаковый состав ( в молярных долях вещества, образующего азеотропную смесь), и что точки кипения этих азеотропных смесей будут понижаться в следующее порядке: ароматические углеводороды, диолефины, моноолефины, циклопарафины, парафины. [27]
 |
Схематическое изображение хроматографирова-ния. [28] |
При перемещении подвижной фазы вместе с ней перемещаются находящиеся в этой фазе вещества. Равновесие их распределения по фазам тем самым нарушается. Вещества, находящиеся в подвижной фазе, встречают чистую неподвижную фазу и частично переходят в нее. В то же время вещества, которые находятся в неподвижной фазе, приходят в соприкосновение со свежей подвижной фазой и постепенно переходят в нее. Таким образом, при непрерывном перераспределении между обеими фазами вещества перемещаются вместе с подвижной фазой. Причина этой разности - удерживание веществ неподвижной фазой. При этом удерживание усиливается с увеличением молярной доли вещества в неподвижной фазе. [29]
Страницы: 1 2