Абсорбция - триоксид - сера
Cтраница 1
 |
Фазовая диаграмма тройной системы H2O - H2SO4 - SO3. [1] |
Абсорбция триоксида серы - последняя стадия процесса, в результате которой образуется серная кислота. [2]
Абсорбция триоксида серы - последняя стадия процесса, в которой образуется серная кислота. [4]
 |
Схема отделения абсорбции в производстве серной кислоты. [5] |
Образование серной кислоты и абсорбция триоксида серы - экзотермические процессы. Их тепло снимается в оросительных теплообменниках 3 на линии циркуляции жидкости в абсорберах. Диоксид серы практически не абсорбируется. [6]
 |
Зависимость Ко от концентрации при различной температуре кислоты.| Зависимость степени абсорбции SO3 в моногидратном абсорбере от. концентрации кислоты при различной температуре. [7] |
На рис. 72 приведена зависимость степени абсорбции триоксида серы в олеумном абсорбере, орошаемом 20 % - ным олеумом, от температуры при различном содержании S03 в газе. Из этих данных видно, что с повышением температуры степень абсорбции SO3 сильно уменьшается и при определенной температуре 84 С при 7 5 % SO3 в газе и 76 С при 5 % SO3) абсорбция полностью прекращается. [8]
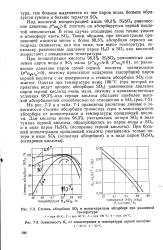
На рис. 71 приведены расчетные данные о зависимости степени абсорбции триоксида серы в моногидратном абсорбере от концентрации и температуры орошающей кислоты. Из этого рисунка видно, что 98 3 % - ная серная кислота обладает наиболее высокой абсорбционной способностью. С понижением и повышением концентрации H2SO4 степень абсорбции кислоты уменьшается тем более резко, чем выше температура кислоты. [9]
Основным промышленным методом получения H2SO4 является каталитическое окисление SO2 кислородом воздуха до 8Оз с последующей абсорбцией триоксида серы серной кислотой во избежание образования тумана. Катализатором в таком процессе служит V2O5 с добавками K2SO4 или Rb2SO4 в качестве активаторов, а окисление S02 проводят при температуре около 500 С. [10]
 |
Степень абсорбции SO3 в моногидратном абсорбере при различной.| Зависимость Ко от концентрации и температуры серной кислоты. [11] |
На рис. 7 - 2 и в табл. 7 - 1 приведены расчетные данные о зависимости степени абсорбции триоксида серы в моногидратном абсорбере от концентрации и температуры орошающей кислоты. [12]
Реакция (II.1) является основной во многих промышленных процессах, рассмотренных в последующих главах учебника, например для окисления диоксида серы, абсорбции триоксида серы, синтезах аммиака, хлороводорода, спиртов, высокомолекулярных соединений и во многих других органических и неорганических синтезах. [13]
 |
Схема производства серной кислоты из серы по методу ДК. [14] |
Если сера содержит органические вещества ( остатки флотореагентов) то при их сгорании образуются пары воды и затем сернокислотный туман, затрудняющий абсорбцию триоксида серы. Для уменьшения количества тумана абсорбцию иногда ведут в горячем режиме - при повышенной температуре кислоты в башне от 70 - 80 до НО-140 С. [15]
Страницы: 1 2
