Ацилирование - ароматическое соединение
Cтраница 1
Ацилирование ароматических соединений - A j ( титрование по Фрвделю - Кра подробно описано в элементарных руководствах, здесь приведено только примера. [1]
Ацилирование ароматических соединений по Фриделю - Крафтсу является важнейшим методом синтеза жирноаромати-ческих етонов. [2]
Ацилирование ароматических соединений галогенангидридами отличается от алкилирования галогеналкилами тем, что в первом случае редко наблюдается образование ди - и полиацилзамещенных; алкильный остаток в ацилирующем агенте не подвергается перегруппировкам; редко встречаются реакции диспропор-ционирования; для проведения реакции необходим немного больше моля катализатора. [3]
Ацилирование ароматических соединений по Фриделю - Крафт-су проводят хлорангидридами или ангидридами кислот. [4]
Ацилирование ароматических соединений по Фриделю и Крафтсу и, в особенности, реакция Фриса [57] до некоторой степени сходны с ацилированием кетонов в присутствии трехфтористого бора. В отдельных случаях ацилирование по Фриделю и Крафтсу в присутствии трехфтористого бора сопровождается ацилированием образующихся кетонов до р-дикетонов ( стр. [5]
Ацилирование ароматических соединений галогенангндридами отличается от алкилирования галогеналкилами тем, что в первом случае редко наблюдается образование ди - и полиацилзамещенных; алкильный остаток в ацилирующем агенте не подвергается перегруппировкам; редко встречаются реакции диспропор-ционирования; для проведения реакции необходим немного больше моля катализатора. [6]
Для ацилирования ароматических соединений используются гало-генангидриды и ангидриды кислот, реже - сами карбоновые кислоты и их эфиры. Обычно эти реакции проводятся с катализаторами Фриделя - Крафтса, чаще всего с хлоридом алюминия, и этим напоминают уже рассмотренные ( см. 6.1) реакции алкили-рования. Однако активность галогенангидридов растет при переходе от фтор - к иодпроизводным, в то время как алкилгалогениды образуют обратный яд. Это свидетельствует о том, что активация галогенангидридов хлоридом алюминия осуществляется по иному механизму. [7]
Для ацилирования ароматических соединений используются гало-генангидриды и ангидриды кислот, реже - сами карбоновые кислоты и их эфиры. Обычно эти реакции проводятся с катализаторами Фриделя - Крафтса, чаще всего с хлоридом алюминия, и этим напоминают уже рассмотренные ( см. 6.1) реакции алкили-рования. Однако активность галогенангидридов растет при переходе от фтор - к иодпроизводным, в то время как алкилгалогениды образуют обратный ряд. Это свидетельствует о том, что активация галогенангидридов хлоридом алюминия осуществляется по иному механизму. [8]
При ацилировании ароматических соединений стадией, определяющей - скорость реакции, является взаимодействие комплекса ацилирующего агента и кислоты Льюиса с ароматическим соединением. [9]
Обычно реакция ацилирования ароматических соединений проводится с использованием катализаторов Фриделя - Крафтса, чаще всего хлористого алюминия, и напоминает уже рассмотренные реакции алкилирования. [10]
Обычно реакции ацилирования ароматических соединений проводятся с использованием катализаторов Фриделя - Крафтса, чаще всего А1СЬ, и этим напоминают уже рассмотренные реакции алкилирования. Однако по своей реакционной способности галоген-ангидриды кислот образуют ряд, обратный ряду галогеналкилов ( ср. [11]
Синтез кетонов ацилированием ароматических соединений по методу Фриделя-Крафтса дает значительно лучшие выходы, чем синтез алкилбензолов. Препаративное применение этого метода для получения кетонов значительно шире, чем для получения алкилбензолов. Введение в молекулу карбонильной группы затрудняет дальнейшее замещение, благодаря этому при конденсации ароматических соединений с хлоран-гидридами кислот или другими ацилирующими агентами образуются однородные продукты реакции с хорошим выходом. [12]
Синтез кетонов ацилированием ароматических соединений по методу Фриделя-Крафтса дает значительно лучшие выходы, чем синтез а л кил бензолов. Препаративное применение этого метода для получения кетонов значительно шире, чем для получения алкилбензолов. Введение в молекулу карбонильной группы затрудняет дальнейшее замещение, благодаря этому при конденсации ароматических соединений с хлоран-гидридами кислот или другими ацилирующими агентами образуются однородные продукты реакции с хорошим выходом. [13]
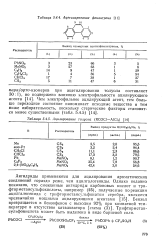 |
Ацетилирование фенантрена э ю.| Ацилирование толуола ( RCOC1 - А1С13. [14] |
Ангидриды применяются для ацилирования ароматических соединений гораздо реже, чем ацилгалогениды. Трифторметан-сульфокислота может быть выделена в виде бариевой соли. [15]
Страницы: 1 2