2-фенилоксазолон
Cтраница 1
Молекулы 2-фенилоксазолона - 5 конденсируются друг с другом. Продуктом этой конденсации является З - бензоиламино-1 - бензоил-2 4-дикетопирролидин [ см. стр. [1]
При получении а-кетокислот из 2-фенилоксазолонов приходится отделять продукт реакции от бензойной кислоты. [2]
Фенил-4 - бензилоксазо-лон-5 вступает в реакцию со спиртом быстрее, чем незамещенный 2-фенилоксазолон - 5 который при 25 превращается в соответствующий эфир в течение 16 час. [3]
При обработке капроилглицина уксусным ангидридом, кроме 2-амилоксазолона - 5, был получен ди - М К - капроил-2 5-дикетопи-перазин 20 ( 7С8), причем изучение спектров поглощения показало, что вначале образуется оксазолон, который затем переходит в дикето-пиперазин. Были проведены конденсации 2-фенилоксазолона - 5 с альдегидами, кетонами, ортоэфирами и другими соединениями и оказалось, что 2-фенилоксазолон - 5 легко вступает в реакцию с этими соединениями, давая соответствующие 4-замещенные, ненасыщенные оксазолоны. [4]
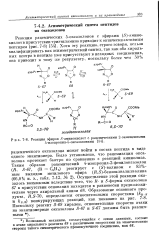 |
Реакция эфиров S-аминокислот с рацемическими 2-замещенными 4-изопропил - 5-оксазолонами. [5] |
Было установлено, что рацемизация оксазолона протекает быстро по сравнению с реакцией аминолиза. Таким образом рацемический 4-изопропил - 2-фенилоксазолон ( Д, S-67, ( R С6Н5) реагирует с ( 5) - валином с 83 % - ным выходом метилового эфира ( Д 5) - бензоилвалилвалина ( 66 8 % и. [6]
При обработке капроилглицина уксусным ангидридом, кроме 2-амилоксазолона - 5, был получен ди - М К - капроил-2 5-дикетопи-перазин 20 ( 7С8), причем изучение спектров поглощения показало, что вначале образуется оксазолон, который затем переходит в дикето-пиперазин. Были проведены конденсации 2-фенилоксазолона - 5 с альдегидами, кетонами, ортоэфирами и другими соединениями и оказалось, что 2-фенилоксазолон - 5 легко вступает в реакцию с этими соединениями, давая соответствующие 4-замещенные, ненасыщенные оксазолоны. [7]
Предложенный метод был проверен со многими альдегидами и кетонами51 - 75 и почти во всех случаях оксазолоны были получены с более высоким выходом, чем с уксуснокислым натрием. На основании этих данных можно сделать вывод, что причиной низких выходов оксазолонов при проведении реакции с жирными альдегидами является не влияние ионов натрия и калия, а влияние уксусной кислоты, которая образуется при циклизации гиппуровой кислоты в 2-фенилоксазолон - 5 и которая изменяет рН среды. Следовательно, устранение уксусной кислоты является необходимым условием для нормального течения реакции конденсации, особенно при реакциях с альдегидами жирного ряда. Уксуснокислый натрий недостаточно ослабляет влияние уксусной кислоты. Лучшим буфером является уксуснокислый свинец. Применение поташа дает возможность нейтрализовать уксусную кислоту, и потому в присутствии поташа выход оксазолонов выше, чем с уксуснокислым натрием. [8]
Страницы: 1