Масса - растворитель
Cтраница 3
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют растворимостью этого вещества или коэффициентом растворимости. [31]
Здесь парциальный удельный объем v относится к не-сольватированной частице, a w - масса растворителя с плотностью р, сольватирующего 1 г чистого растворенного вещества. Таким образом, величина, стоящая в скобках, выражает вызванное гидратацией относительное увеличение объема частицы. [32]
Простейший случай такой реакции - обмен молекулами растворителя между сольватированным катионом металла и массой растворителя. Наиболее непосредственные измерения скоростей таких реакций - это данные Таубе по изотопному обмену; они указывают на измеримые скорости обмена и значительные энергии активации для иона А13 в воде и Mg2, Co2 и Ш2 в метаноле ( стр. [33]
Кэ - эбуллиоскопическая постоянная; т - масса растворенного вещества; / пр - масса растворителя. Если величина Кя заимствована из таблиц и является точной, то ошибка в определении молекулярной массы AM будет функцией ошибок Am, Amp и Д ( ДТ кип) непосредственно измеряемых величин. [34]
Жкаж и Мист - кажущиеся и истинные молекулярные массы полимера соответственно; т2 - масса растворителя 2, отнесенная к единице массы полимера; Vj и v2 - инкременты показателей преломления для первого и второго растворителей соответственно. [35]
Не следует, однако, отождествлять эти понятия, так как масса раствора включает массу растворителя и растворенных веществ. Массовая же концентрация ( титр) характеризует только массу растворенного вещества. [36]
Сущность процесса извлечения смолистых веществ из осмола сводится к их диффузии из древесины в массу растворителя. Эти факты и должны учитываться при осуществлении процесса в производстве. [37]
 |
Криоскопические постоянные ( К некоторых растворителей. [38] |
К - криоскопическая постоянная растворителя; а - навеска вещества, г; А - масса растворителя, г; Д4 - понижение температуры замерзания данного раствора, С. [39]
При растворении кристаллов происходит их разрушение и распределение молекул ( или ионов) по всей массе растворителя, что требует затраты энергии. Поэтому растворение должно было бы сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что одновременно с растворением происходит какое-то взаимодействие между растворителем и растворенным веществом, при котором выделяется в виде теплоты больше энергии, чем ее расходуется на разрушение кристаллической решетки. [40]
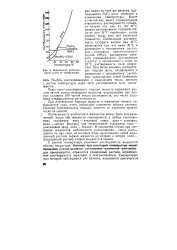 |
Зависимость растворимости солей от температуры. [41] |
Чаще всего растворимость твердых веществ выражают числом частей массы безводного вещества, насыщающим при данных условиях ГОО частей массы растворителя; это число называют коэффициентом растворимости. [42]
Таким образом, для определения молярной массы растворимого в данном растворителе вещества необходимо знать массу растворенного вещества, массу растворителя, молярную массу растворителя, давление его насыщенного пара при данной температуре ( можно воспользоваться табличными данными) и экспериментально измеренное давление пара над раствором при той же температуре. Например, требуется определить молярную массу вещества, 21 24 г которого растворено в 100 г воды при 0 С. Экспериментально измеренное давление пара над раствором равно 590 5 Па при О С, давление насыщенного пара воды ( при 0 С) составляет 610 7 Па, парциальное давление исследуемого вещества при этой температуре очень мало. [43]
Для приготовления 25 % - ного раствора из 50 % - ного следует 25 единиц массы последнего разбавить 25 единицами массы растворителя. [44]
Кэ - величина мольного повышения температуры кипения или эбулиоскопическая постоянная растворителя; а - навеска вещества, г; А - масса растворителя, г; Дг - повышение температуры кипения, С. [45]
Страницы: 1 2 3 4