Окисная медь
Cтраница 2
При нагревании моносахаридов с фелинговой жидкостью окисная медь восстанавливается до закисной, а альдегидная группа моносахарида окисляется до карбоксильной. Красная закись меди выпадает в осадок. Реакцию используют для количественного определения Сахаров. [16]
При нагревании альдегидов с фелинговой жидкостью окисная медь восстанавливается до закисной, а альдегид окисляется до кислоты. [17]
Так, например, моменты комплексов окисной меди часто составляют около 1 9 вместо 1 73 магнетона Бора, а комплексы трехвалентного хрома имеют моменты около 3 80 вместо 3 88 магнетона Бора. Причиной этого расхождения является то, что хотя спин-орбитальное взаимодействие в ионе и не может вызвать расщепления основного состояния, не обладающего орбитальным угловым моментом, оно способно вызвать примешивание некоторых более высоких уровней, обладающих орбитальным угловым моментом. Чтобы это примешивание было эффективным, высшие уровни должны обладать такой же мультиплетностью ( значением S), как и основное состояние. [18]
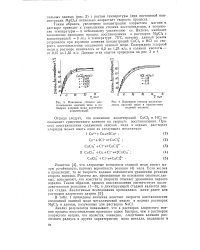 |
Изменение степени восстановления окисной меди в растворах хлорной меди различных концентраций.| Изменение степени восстанов. [19] |
Известно [4], что хлоридные комплексы окисной меди имеют малую устойчивость, поэтому вероятность реакции ( 4) мала. Если же она и происходит, то ее скорость должна подчиняться уравнению реакции второго порядка. Расчеты же, проведенные на основании опытных данных, показывают, что константа скорости отвечает уравнению первого порядка. Таким образом, процесс восстановления соответствует последовательным реакциям ( 1 - 3), а лимитирующей стадией является первая стадия. [20]
Особенно удобны для этих целей комплексные соли окисной меди, в частности реактив Фелинга, являющийся щелочным раствором комплексной винно-медной соли ( стр. [21]
Эту реакцию можно рассматривать как образование ацетиленида окисной меди, неизбежно дающей диацетилен. В этом отношении ацетилениды двухвалентной меди напоминают цианиды меди, легко дающие дициан. Возможно, что и реакции, направленные на получение ацетиленидов других металлов, приводят к подобному разложению. [22]
Полученные данные показывают, что скорости восстановления окисной меди резко возрастает как с ростом поверхности раздела фаз, так и с увеличением интенсивности перемешивания, что подтверждает предположения, высказанные ранее. [23]
Далее Кельт предполагает, что роль соли окисной меди заключается в отрыве одного электрона от радикала, образующегося при присоединении арильной группы. [24]
Наиболее употребительна реакция Троммера, заключающаяся в восстановлении окисной меди в закисную. [25]
Дифференциальное и Потенциометрическое титрование окисного железа, ванадата и окисной меди. [26]
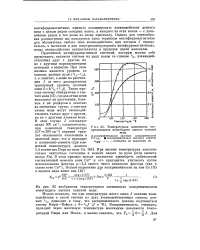 |
Температурная зависимость восприимчивости моногидрата ацетата окисной меди. [27] |
На рис. 82 изображена температурная зависимость восприимчивости моногидрата ацетата окисной меди. [28]
Количественное исследование разложения перекиси водорода под действием только ионов окисной меди было проведено Киссом и Ледерером [93], но и оно не является достаточно полным. Эта реакция гораздо более медленна, чем катализ ионами окисного железа при таких же концентрациях реагентов и таких же значениях кислотности. [29]
Метод основан на способности глюкозы в щелочном растворе восстанавливать окисную медь в закисную. При взаимодействии раствора глюкозы с феллинговой жидкостью, содержащей медь, образуется осадок закиси меди, количество которого соответствует количеству сахара в растворе. Этот осадок растворяют сернокислым окисным железом в присутствии серной кислоты; окисное железо при этом окисляет медь и вос. [30]
Страницы: 1 2 3 4