Молярная дробь
Cтраница 1
Молярная дробь равна отношению числа молекул данного компонента Л к общему числу молекул, имеющихся в растворе. Из (2.24) и (2.25) следует, что молярная дробь - отвлеченное число. [1]
Молярная дробь равна отношению числа молекул данного компонента Ni к общему числу молекул, имеющихся в растворе. Из (2.24) и (2.25) следует, что молярная дробь - отвлеченное число. [2]
Молярные дроби наиболее подходят для выражения концентт рации таких растворов, объем которых не зависит или мало зависит от состава. [3]
Молярные дроби наиболее подходят для выражения концентрации таких растворов, объем которых не зависит или мало зависит от состава. [4]
Молярные дроби NA, NB, NC характеризуют концентрацию раствора. [5]
Иногда вместо молярных дробей применяют весовые проценты. [6]
Выраженная в молярных дробях растворимость H2S возрастает при переходе от циклогексана к гексану - бромбензолу - хлорбензолу - четыреххлористому углероду - октану - бензолу - бромоформу - толуолу - хлороформу. [7]
Выраженная в молярных дробях растворимость H2S возрастает при переходе от циклогексана к гексану - бромбензолу - хлорбензолу - четыреххлористому углероду - октану - бензолу - бромоформу - толуолу - хлороформу. [8]
Однако, в отличие от молярных дробей, объемные дроби зависят от температуры и давления, поскольку молярные объемы У4 являются функциями этих переменных. [9]
Однако, в отличие от молярных дробей, объемные дроби зависят от температуры и давления, поскольку молярные объемы Vi являются функциями этих переменных. [10]
Следовательно, если концентрации выражены в молярных дробях, то коэффициент активности характеризует отклонение химического потенциала, а значит, и других свойств компонента i от свойств этого компонента в идеальном растворе. [11]
Таким образом, активность вещества в ненасыщенном растворе будет равна отношению молярных дробей растворенного вещества в ненасыщенном и насыщенном растворах - безразмерной концентрации. [12]
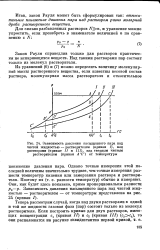 |
Зависимость давления насыщенного пара над. [13] |
Итак, закон Рауля может быть сформулирован так: относительное понижение давления пара над раствором равно молярной дроби растворенного вещества. [14]
При расчете многих важных нефтезаводских процессов, например абсорбции или некоторых случаев экстракции, а также при расчете реакторов и отгонных колонн наряду с рассмотренными весовыми и молярными дробями для характеристики системы приходится пользоваться и другими, более удобными способами представления состава фаз. [15]
Страницы: 1 2 3