Хромовокислый барий
Cтраница 2
Вычислить, сколько граммов бария было потеряно при промывании осадка хромовокислого бария 120 мл воды. [16]
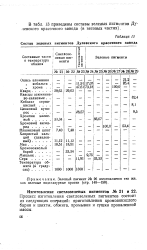 |
Состав зеленых пигментов Дулевского красочного завода. [17] |
Процесс изготовления светлозеленых пигментов состоит из следующих операций: приготовления хромовокислого бария и шихты, обжига, промывки и сушки прокаленной массы. [18]
Зная удельную активность взятой соли стронция, вычисляют в процентах загрязненность осадка хромовокислого бария хромовокислым стронцием без переосаждения и после очистки переосаждением. [19]
Хромовокислый калий осаждает из нейтральных или уксуснокислых растворов бариевых солей желтый осадок хромовокислого бария. [20]
Хромовокислый калий осаждает из нейтральных или уксуснокислых растворов бариевых солей желтый осадок хромовокислого бария. [21]
Принцип и од ом етр и ч ее кого метода определения сульфат-иона с хромовокислым барием заключается в следующем. К исследуемой воде прибавляют сухого хромовокислого бария и соляной кислоты. При этом хромовокислый барий растворяется. Ионы SO, содержащиеся в воде, связывают эквивалентное количество ионов Ва и осаждаются в виде сернокислого бария. Затем раствор нейтрализуют аммиаком и оставшиеся в растворе ионы бария снова выпадают в осадок в виде хромовокислого бария. [22]
Зная удельную активность взятой соли стронция, вычисляют ( в %) загрязненность осадка хромовокислого бария хромовокислым стронцием без переосаждения и после очистки переосаждением. [23]
При осаждении Ва хромовокислым калием К2СгО4 или двухромовокислым калием К2Сг2О7 ( в присутствии уксуснокислого натрия NaC2H3O2) получается желтый осадок хромовокислого бария ВаСгО4, растворимый в сильных кислотах, но нерастворимый в уксусной кислоте. Реакции протекают по нижеследующим уравнениям. [24]
При осаждении Ва хромовокислым калием К2СЮ4 или двухромовокислым калием К2Сг2О7 ( в присутствии уксуснокислого натрия NaC2H3O2) получается желтый осадок хромовокислого бария BaCrCXi, растворимый в сильных кислотах, но нерастворимый в уксусной кислоте. Реакции протекают по нижеследующим уравнениям. [25]
При осаждении Ва хромовокислым калием K jCrO4 или двухромовокислым калием К Сг2О7 ( в присутствии уксуснокислого натрия NaQH3O 2) получается желтый осадок хромовокислого бария ВаСгО4, растворимый в сильных кислотах, но не растворимый в уксусной кислоте. Реакции протекают согласно следующим уравнениям. [26]
К 200 мл исследуемой воды прибавляют 2 мл 4 % раствора соляной кислоты и около 0 5 г ( на кончик ножа) сухого хромовокислого бария, нагревают пробу, поддерживая очень слабое кипение в течение 10 минут, после чего охлаждают до комнатной температуры и нейтрализуют 10 % раствором аммиака до появления заметной щелочной реакции на лакмус. Перед пробой на лакмус воздух над раствором продувают при помощи груши для удаления паров аммиака. [27]
Вычислить число мл 3 М раствора углекислого натрия, необходимое для превращения в углекислый барий и хромовокислый натрий 10 процентов навески в 2 53 г хромовокислого бария. [28]
По 200 ( 100) мл водной вытяжки грунта или воды пипеткой переносят в колбы емкостью по 250 мл, нагревают до кипения, прибавляют по 10 мл раствора хромовокислого бария и кипятят 5 мин. Сняв колбы с нагревателя, вводят в каждую колбу по 1 капле фенолфталеина и нейтрализуют по каплям 20 % - ным раствором едкого натра, не содержащим карбонатов, до щелочной реакции раствора. Такое же количество щелочи прибавляют во все остальные колбы При этом выпадает в осадок непрореагировавший хромовокислый барий. Если в какой-либо колбе не появится малиновое окрашивание, то во все колбы вводят дополнительно по несколько капель раствора щелочи. [29]
Так же составлены данные для соединений II группы: сначала идет горизонтальная графа с хлористыми соединениями и их гидратами, куда отнесено и одно фтористое соединение ( BaF2); затем идут окислы и сопоставленные с ними сернистые соединения, затем-азотнокислые соли и сопоставленный с ними водный хлорновато-кислый барий; затем сернокислые соли и сопоставленный с ними хромовокислый барий; наконец, углекислые соли. При этом соединения закисной формы у элементов данной группы ( например, у ртути) записываются рядом с соединениями окисной формы. [30]
Страницы: 1 2 3 4