Энергетический барьер - активация
Cтраница 1
Энергетический барьер активации, который отделяет реагенты от продуктов, можно понизить при помощи катализатора. Катализатор-это вещество, которое повышает скорость реакции, но в результате само не подвергается окончательному химическому превращению. Различают гомогенные катализаторы, находящиеся в том же фазовом состоянии, что и реагенты, и гетерогенные катализаторы, которые по фазовому состоянию отличаются от реагентов. Гетерогенные катализаторы играют чрезвычайно важную роль в крупнотоннажных промышленных химических процессах, а также в таких устройствах, как каталитические преобразователи выхлопных газов для автомобилей. [1]
При сравнении энергетических барьеров активации различных фурокса-нов бросается в глаза, что главным структурным фактором, снижающим высоту барьера, является коидеисироваииость фуроксанового кольца с ароматическим. Действительно, ДС при переходе от простых фуроксанов ( 30 - 32 ккал / моль) к бензофуроксанам ( 13 - 15 ккал / моль) снижается на - 17 ккал / моль. Скорость взаимного превращения изомеров беизофуроксанового ряда в растворах при обычных температурах настолько велика, что время жизни изомеров измеряется долями секунды. [2]
При сравиеиии энергетических барьеров активации различных фурокса-нов бросается в глаза, что главным структурным фактором, снижающим высоту барьера, является коидеисироваииость фуроксанового кольца с ароматическим. Действительно, ДС при переходе от простых фуроксанов ( 30 - 32 ккал / моль) к бензофуроксанам ( 13 - 15 ккал / моль) снижается на - 17 ккал / моль. Скорость взаимного превращения изомеров беизофуроксанового ряда в растворах при обычных температурах настолько велика, что время жизни изомеров измеряется долями секунды. [3]
Поскольку действие фермента заключается в понижении энергетического барьера активации, обратная реакция катализуется в той же мере. В конце концов, независимо от наличия катализатора устанавливаются те же самые конечные условия равновесия; фермент лишь ускоряет их достижение. [4]
Потенциальная энергия, а следовательно, и энергетический барьер активации являются функцией расстояния между атомами. На рис. 12 изображен энергетический путь реакции как функция расстояния между атомами при взаимодействии молекулы водорода с атомом брома. Показана проекция поверхности потенциальной энергии системы из трех атомов. [5]
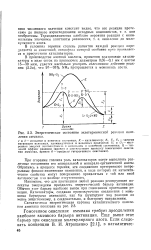 |
Энергетическое состояние экзотермической реакции окисления аммиака. [6] |
Напомним, что для протекания любой реакции реагирующие молекулы вынуждены преодолеть энергетический барьер активации. Обычно этот барьер наиболее высок при гомогенном протекании реакции. Катализаторы, создавая промежуточные соединения с меньшими барьерами активации, как бы шунтируют ход реакции по менее энергоемкому, а следовательно, и быстрому направлению. [7]
Скорость подавляющего большинства реакций возрастает с повышением температуры, поскольку сообщаемая системе дополнительная энергия помогает молекулам преодолеть энергетический барьер активации. Некоторые реакции вообще не имеют свободной энергии активации; это означает, что К. О таких процессах говорят, что они контролируются диффузией. [8]
На рис. 8 - 8 приведена аналогичная ситуация для химической реакции. Сплошная кривая показывает энергетический барьер активации, который необходимо преодолеть для осуществления реакции. Если же ввести катализатор, то реакция может протекать по иному пути с другим энергетическим барьером, как показано пунктирной кривой. [9]
 |
Структура графита. [10] |
Хотя величина ДО0 очень мала, она имеет положительное значение, а свободная энтропия превращения Д5 - отрицательное значение, и это показывает, что при нормальных условиях ( 25 С и 1 атм) нет никаких оснований беспокоиться о возможности самопроизвольного перехода оловянной посуды в серое порошкообразное олово, так как движущая сила такого превращения недостаточно велика. Если даже пренебречь энергетическим барьером активации для такого превращения, то довольно ясно, что белое олово должно превращаться в серое олово лишь с очень небольшой скоростью, поскольку стандартная свободная энергия перехода ДО очень мала и, по-видимому, должна быть столь же невелика, хотя и отрицательна, при температурах, несколько меньших температуры фазового превращения 13 2 С. [11]
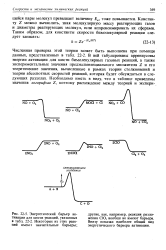 |
Энергетический барьер активации для шести реакций, указанных в 22 - 2. Некоторые из этих реакций имеют значительные барьеры. [12] |
СЮ, вообще не имеют барьера. Внизу показан наиболее общий вид энергетического барьера активации. [13]
 |
Диаграмма потенциальной энергии для реакции Н2 I2 2HI. [14] |
Каждая стадия обратной реакции представляет собой обращение соответствующей стадии прямой реакции. Обратная реакция протекает с большим трудом, чем прямая реакция, поскольку энергетический барьер активации обратной реакции молекулами приходится преодолевать целиком на первой стадии, и он оказывается выше обоих барьеров, через которые осуществляется прямая реакция. Одна из причин, позволяющих катализа. Хотя механизм действия твердых катализаторов исследован еще недостаточно полно, можно полагать, что молекулы реагентов прилипают, или, как говорят, адсорбируются, на поверхности катализатора, что позволяет им затем легче превращаться в активированный комплекс. [15]
Страницы: 1 2