Небольшой энергетический барьер
Cтраница 2
Дипольные моменты л метилметоксисиланов [71, 195] и тетра-гс-алкоксисиланов [195, 208] удовлетворительно совпадают со значениями [ I, вычисленными для тетраэдрической модели молекул этих соединений, предполагающей свободное вращение вокруг связи Si - О. При наличии у атома кремния двух или более фе-ноксигрупп [207] или разветвленных алкоксигрупп в фе-нилтриалкоксисиланах [202] вращение вокруг связи Si - О значительно ограничивается. Небольшой энергетический барьер вращения существует во всех алкоксисиланах, но он не настолько велик, чтобы ограниченность вращения была оценена по значениям дипольных моментов. [16]
Другая картина будет наблюдаться, если при активирующих столкновениях молекулы обладают значительной кинетической энергией. Так как опытная энергия активации ( постоянная ЕА в уравнении Аррениуса) обычно значительно превышает теплоту испарения растворенного вещества, то активные молекулы растворенного вещества могут передвигаться в жидкости по крайней мере так же свободно, как в газовой фазе. Относительно небольшой энергетический барьер, преодолеваемый молекулами при переходе от одной сольватной оболочки к другой, составляет только небольшую долю общей энергии активации. [17]
Многие структурные изменения происходят за время порядка времени одного колебания, поскольку они по существу обусловлены колебаниями, у которых силовая постоянная становится отрицательной. Эти времена имеют порядок 10 - 12 с, тогда как большинство фотохимических реакций требует 10 - 9 - 10 - 6 с. Другие структурные изменения могут иметь небольшой энергетический барьер и могут протекать медленнее. Это возможно только для очень простых молекул. [18]
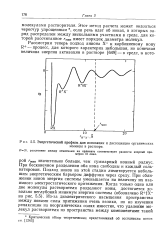 |
Энергетический профиль для ионизации и диссоциации органических. [19] |
Гмин значительно больше, чем суммарный ионный радиус. При бесконечном разделении оба иона свободны и каждый соль-ватирован. Подход ионов на этой стадии лимитируется небольшим энергетическим барьером диффузии через среду. При сближении ионов энергия системы уменьшается на величину их взаимного электростатического притяжения. [20]
 |
Структурная классификация полиморфизма. [21] |
Полиморфные превращения, связанные с изменением во вторичной координационной сфере. При этих превращениях изменяется число дальних соседних атомов, а число окружающих данный атом ближайших соседних не изменяется. Подобные превращения со смещением во вторичной координационной сфере происходят без нарушения связей и протекают быстро вследствие небольшого энергетического барьера. [22]
Если закрепления краев оболочки исключают возможность чисто изгибной деформации, то при потере устойчивости поведение тонких оболочек становится качественно иным. Точка бифуркации соответствует неустойчивому начальному состоянию равновесия и в окрестности критической точки бифуркации нет новых устойчивых состояний равновесия. Поэтому переход в новое возмущенное состояние равновесия происходит хлопком: переходя в новое устойчивое состояние оболочка перескакивает через статически неустойчивые состояния равновесия. Новые устойчивые состояния равновесия, отделенные от начального невозмущенного состояния сравнительно небольшим энергетическим барьером, становятся возможными до достижения критической нагрузки. [23]
Чаще всего все же происходит обмен электронами между адсорбированной молекулой и поверхностью, при котором образуется довольно сильная химическая связь между ними и о молекуле тогда говорят, что она хемосорбирована. Но чаще волновые функции валентных электронов молекулы смешиваются с волновыми функциями валентных электронов подложки, образуя новую волновую функцию. Тогда можно считать, что электроны, отвечающие за связь, движутся по орбитам между подложкой и адатомами и образуют тем самым ковалентную связь. На рис. 6.2 показан простой пример графика потенциальной энергии для случая хемосорбции. Некоторые из падающих на образец молекул аккомодируют на поверхности и становятся слабо связанными в физосорбированном состоянии ( называемом также состоянием-предшественником), имеющем энергию связи Ер. В период их пребывания в этом состоянии могут произойти электронные или колебательные процессы, которые позволят им преодолеть небольшой энергетический барьер Ес ( энергия активации ЕС ЕР), в результате чего возникает электронный обмен между адсорбатом и подложкой. Каждый адатом теперь оказывается в гораздо более глубокой яме Е &. Диапазон энергий связи ( теплот адсорбции) при хемосорбции достаточно велик, от 0 43 эВ для азота на никеле до 8 4 эВ для кислорода на вольфраме. [24]
Страницы: 1 2