Тафелевский наклон
Cтраница 1
Тафелевские наклоны 2RT / F для третьей стадии в качестве замедленной в двух последних путях получаются [21, 128] при 0 - 1 и поэтому относятся к более высоким потенциалам. [1]
Выведенные значения тафелевского наклона остаются справедливыми также и при квазиравновесной трактовке. Хотя для стационарного состояния можно найти общие уравнения, однако при этом обычно [6, 103] выбирают соответствующие предельные значения констант скорости, что эквивалентно начальному предположению о квазиравновесии. Это следует из того, что кинетически значимые тафелевские наклоны наблюдаются в условиях, когда лимитирующей является только одна-единственная стадия, что эквивалентно-требованию об установлении квазиравновесия в предшествующих стадиях. [2]
Во всех случаях тафелевские наклоны на платине, палладии, родии и железе имели значение, близкое к RT / F. Как показано выше, этот результат свидетельствует в пользу предположения о том, что лимитирующей является стадия разложения, протекающая по уравнению первого порядка. [3]
Это соответствует наблюдаемому тафелевскому наклону для катодного направления процесса. [4]
С этой точки зрения уменьшение тафелевского наклона от 120 до 60 мВ и отсутствие влияния состава раствора на перенапряжение водорода в области низких т ( см. рис. 136) обусловлено изменением лимитирующей стадии, а не переходом от обычного разряда к безбарьерному. [5]
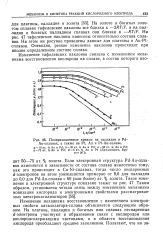 |
Поляризационные кривые на палладии и Pd-Au - сплавах, а также на Pt, Аи и Pt-Аи - сплаве. [6] |
На золоте и богатых золотом сплавах тафелевские наклоны все близки к - 2RT / F, а на палладии и богатых палладием сплавах они близки к - RT / F. На рис. 47 тафелевские наклоны нанесены относительно состава сплавов. На этом же рисунке приведены данные для платины и Au-Pt - сплавов. Очевидно, резкое изменение наклонов происходит при вполне определенном составе сплава. [7]
На восстановленном графите [103], где наблюдались истинные тафелевские наклоны от 2 3 RTJ2F до 2 - 2 3 RT / 3F, имеет место изменение механизма. Реакция протекает через две последовательные стадии со сравнимыми токами обмена: разряда и электрохимической десорбции. Окисление поверхности снижает энергию связи атома хлора с поверхностью, что приводит к росту энергии активации и перенапряжения. [8]
С учетом изложенного постоянные Ьа и & называют также тафелевскими наклонами. [9]
Поэтому сделать вывод относительно механизма реакции, основываясь на величине тафелевских наклонов, труднее, чем при соблюдении условий Ленгмюра. Добавим, что в условиях Темкина наклон RT / 2F наблюдается в том случае, если конечной стадией является рекомбинация, независимо от числа предыдущих стадий. [10]
Лоренц и др. [245, 246] показали, что для поликристаллического механически обработанного железа тафелевский наклон составляет 30 м Порядок реакции по гидроксильным ионам 2, в то время как для хоро-що рекристаллиэованного железа параметры приближаются к 40 мВ и I соответственно. При высокой плотности тока тафелевский наклон возрастает даже после коррекции омического потенциала в растворе. [11]
Однако в сочетании с другими данными, такими, как порядок реакции, тафелевские наклоны, заполнение электрода адсорбированным Н, использование величины S представляет значительную ценность. Изучено также соотношение между S и R [337] с тем, чтобы выяснить, не является ли какая-нибудь зависимость между ними характерным свойством механизма. Если сравнить S и R и воспользоваться правилом среднего геометрического, то такой подход позволяет обойтись без абсолютной оценки отношения функций состояния для активированного комплекса. Кроме того, экспериментально с большей точностью легче определить R, чем S. Это позволяет связать функции состояния Н30, Н20, HD20 и D 0 и соответствующих активированных состояний комплексов. [12]
Итак, конечная форма кинетического уравнения скорости и, следовательно, ожидаемое значение тафелевского наклона не зависят от вида функции g ( 6), которая определяет скорость изменения с покрытием кажущейся стандартной свободной энергии адсорбции. [13]
К / 2 3) / Rp, где К - коэффициент, полученный делением произведения тафелевских наклонов анодной и катодной поляризационных кривых на их сумму; М - атомная масса испытуемого металла; Z - валентность ионов металла; F - постоянная Фарадея. [14]
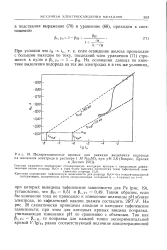 |
Поляризационные кривые для реакции выделения водорода на железном электроде в растворе 1 М Na2SO4 при рН 3 6 ( Бокрис, Дразич. [15] |
Страницы: 1 2 3 4