Накопление - электронная плотность
Cтраница 1
 |
Относительные скорости реакций электрофильного замещения аренов в сравнимых условиях. [1] |
Накопление электронной плотности в ядре бензола по мере роста числа алкильных групп приводит к появлению основных свойств бензольного ядра, которые с большой скоростью возрастают в ряду: 1СН3 2СН3 ЗСН3 4СН3 5СН3 6СН3, несколько изменяясь у различных изомеров. [2]
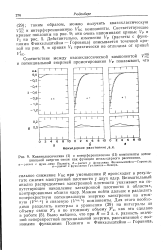 |
Квазиклассическая ( I и интерференционная ( II компоненты потенциальной энергии связи как функции межъядерного расстояния. [3] |
Внимательный анализ распределения электронной плотности указывает на сопутствующее накопление электронной плотности в областях, центрированных вблизи ядер. [4]
 |
Перекрывание АО, ведущее к связыванию. [5] |
Общепринятым объяснением существования прочной химической связи является предположение, что накопление электронной плотности в межъядерной области приводит к такому положению электронов, в котором они могут взаимодействовать с обоими ядрами. [6]
МО, по обе ЛЮ слабее, чем в случае о-орбитали, так как накопление электронной плотности происходит вдали от оптимальных положении. Кроме того, электронная плотность не имеет цилиндрической симметрии ( рис. 15.6 6), как в случае 0-ор-бнтали, и поэтому распределение электронной плотности как качественно, так и количественно иное. Эга разница отражена в обозначении таких орбиталей: когда ЛЮ образуется боковым перекрыванием р-орбнталей, она называется п-орбиталью. Связывающая л разрыхляющая комбинации называются соответственно 2рл - и 2рл - орбиталямн. Разность энергий этих дпух комбинаций схематически показана на рнс. На деле выходит, что в ряде случаев эти электрон-электронные взаимодействия изменяют последовательность энергетических уровней, так что более приемлема картина, изображенная на рис. 15.6, г. Истинное расположение зависит от типа молекулы, как мы УВИТ. ИМ ниже, и точную последовательность энергетических уровней получают или путем расчета, или с использованием разных видов спектроскопии. Особенно четкое изображение эшх глубоко лежащих энергетических уровней дает фотоэлектронная спектроскопия ( гл. [7]
Имея это в виду, мы тем не менее будем связывать прочность химических связей с накоплением электронной плотности в области связывания между ядрами, не уточняя, обусловлена ли эта сила поджатием соответствующих орбиталей или просто изменением ядерно-электронного взаимодействия вследствие накопления электронов в межь ядерной области. [8]
Об усилении вклада первой структуры в восстановленных трмс-дитио-латах говорит и сам факт перехода от предельной тригонально-призмати-ческой конформации комплекса к промежуточной между призматической и антипризматической. Действительно, накопление электронной плотности на лигандах, сопровождающее усиление роли ацидной канонической структуры I, должно усилить чисто электростатическое отталкивание атомов серы друг от друга и, следовательно, усилить тенденцию к антипризматической конформации, при которой расстояния S... S в касаниях соседних лигандов возрастают. В нейтральных / тгрис-дитиолатах эти расстояния в среднем равны 3 05 А, в анионных - 3 21 А. Таким образом, причиной, вызывающей переход от заслоненной конформации к частично-скрещенной, является, по-видимому, усиление электростатического отталкивания эффективных зарядов атомов серы. Остается, однако, неясным, с чем связано преимущество призматического строения перед октаэдри-ческим в исходных молекулярных / ярис-дитиолатах. [9]
 |
Образование 2 / за - МО ( а и 2jpa. - MO ( б. е - предсказанное расположение. [10] |
Связывающая и разрыхляющая комбинации называются соответственно 2рл - и 2р71 - орбитапями. Обе эти МО слабее, чем ст-орбитали, поскольку накопление электронной плотности происходит вдали от оптимальных положений. На самом же деле относительное положение 2рст - и 2рт1 - орбиталей меняется в зависимости от природы молекулы вследствие влияния электрон-электронных взаимодействий. Часто более приемлемой картиной является изображенная на рис. 1.8 г. Точную последовательность энергетических уровней получают или путем расчета, или с помощью разных видов спектроскопии. [11]
Как видно из рис. 12 - 3, а, указанная комбинация атомных орбиталей описывает накопление электронной плотности между ядрами, которым мы выше объяснили образование химической связи. В молекуле водорода обсуждаемая молекулярная орбиталь заполнена двумя электронами, имеющими противоположно направленные ( спаренные) спины, и соответствует образованию простой ковалентной связи. Молекулярная орбиталь подобного типа называется связывающей орбиталью. [12]
Сведения о свойствах водородных связей с участием карбоксилатного аниона, с одной стороны, и катионом аммония, имидазолия или гуанидиния, с другой, еще очень ограничены. Тщательное исследование электронного распределения в пердейтероглицилглицине, выполненное в работе [78] комбинированным методом рентгенографического и нейтронографиче-ского анализа, позволило установить следующие факторы, касающиеся водородных связей, которые образуются группой ND 1 с тремя различными кар-боксилатными группами: 1) в средней части линии, соединяющей атом D и кислородный акцептор, не происходит накопления электронной плотности; 2) векторы N-D направлены в сторону максимума плотности неподеленной пары, а не в сторону центра акцепторного кислорода; 3) плотность неподеленной пары накапливается вблизи линии, соединяющей атомы D и О. Кроме того, эффективные заряды на группах СОО - и NDj составляют от - 0 4 до - 0 5 и 0 4 электрона соответственно. Такая картина находится в соответствии с электростатическими моделями взаимодействия NH3 - ООС. [13]
В квантовой механике нельзя использовать такую аргументацию, поскольку ей чуждо представление о траекториях, но, рассматривая влияние потенциала поля лигандов на волновую функцию электрона, можно прийти к тому же заключению. Влияние потенциала поля лигандов вынуждает электрон дольше задерживаться в областях высокой вероятности, которые расположены в направлении лигандов при создании ими потенциала притяжения и между лигандами при создании ими потенциала отталкивания. Такое накопление электронной плотности означает, что первоначальная бегущая волна превратилась в стоячую ( неподвижными пучностями этой волны являются накопления вероятности), а со стоячей волной не связан никакой угловой момент. Следовательно, угловой момент погашен анизотропным потенциалом. [14]
Образование шести rr - связен выводит перпенчикулярные р-орбитали в положения, где они перекрываются, давая л-связи. Из шести атомных орбитален могут образоваться шесть молекулярных орбнталсй; они показаны на рис. 15.25, где привечены также их энергии. Наиболее сильно связывающая орбиталь образуется, когда все атомные орбитали перекрываются конструктивно, что приводит к накоплению электронной плотности во всех шести областях связывания. [15]
Страницы: 1 2