Кинетическое кривое накопление - гидроперекись
Cтраница 2
 |
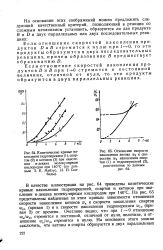
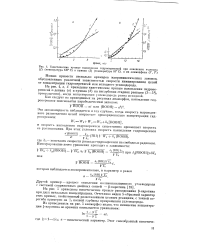
Кинетика накопления продуктов реакции при давлении 20 am и различных температурах. [16] |
На рис. 7 приведены кинетические кривые накопления гидроперекиси при 170 и 180 С. Из них видно, что максимальная концентрация перекиси достигается очень быстро - через 10 мин при 180 С и через 15 мин-при 170 С. [17]
 |
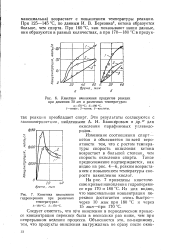
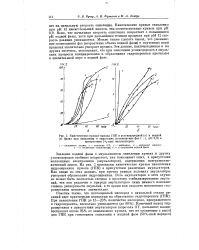
Отношения скорости накопления кетона v к скоростям v накопления спиртов ( 1 и гидроперекисей ( 2, рассчитанные по данным 64. [18] |
В качестве иллюстрации на рис. 64 приведены кинетические кривые накопления гидроперекисей, спиртов и кетонов при окислении н-декана молекулярным кислородом при 140 С. На рис. 65 представлены найденные по этим кривым зависимости отношения скорости накопления кетонов ot к скорости накопления спиртов ( кривая /) и к скорости накопления гидроперекиси ( кривая 2) от времени. [19]
В качестве иллюстрации на рис. 64 приведены кинетические кривые накопления гидроперекисей, спиртов и кетонов при окислении н-декана молекулярным кислородом при 140 С. На рис. 65 представлены найденные по этим кривым зависимости отношения скорости накопления кетонов шк к скорости накопления спиртов шсп ( кривая 1) и к скорости накопления гидроперекиси wm ( кривая 2) от времени. Очетливо видно, что при t - О отношение wJwcn стремится к постояной, отличной от нуля, величине, а отношение wjwrn стремится к нулю. [21]
 |
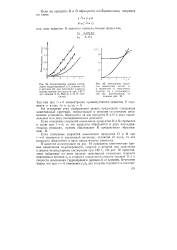
Зависимость скорости окисления кумола от количества катализатора 1 - МпО2. 2 - Со2О3. температура 23 С.| Зависимость выхода продуктов окисления от концентрации Со2Оз. [22] |
Из рис. 2, на котором приведены кинетические кривые накопления гидроперекиси при 90 С, видно, что период торможения зависит от глубины окисления: чем позже введен ингибитор, тем короче период торможения. Такой характер торможения свидетельствует о протекании процесса при этой температуре по разветвленному радикально-цепному механизму. [23]
В качестве иллюстрации на рис. 61 приведены кинетические кривые накопления гидроперекисей, спиртов и кетонов при окислении н-декана молекулярным кислородом при 140 С. На рис. 62 представлены найденные по этим кривым зависимости отношения скорости накопления кетонов WK к скорости накопления спиртов юсп ( кривая У) и к скорости накопления гидроперекиси wfn ( кривая 2) от времени. Отчетливо видно, что при / - vO отношение wK / wca стремится к постоянной, отличной от нуля, величине, а отношение nK wrn стремится к нулю. На основании этого можно заключить, что кетоны и спирты образуются в двух параллельных реакциях, а образование гидроперекисей предшествует образованию кетонов. Этот вывод подтверждается и другими методами. [24]
 |
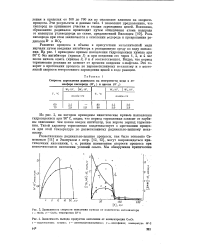
Кинетические кривые накопления гидроперекисей при окислении и-декана ( 1 ( температура 120 С и кумола ( 2 ( температура 81 С, и их анаморфозы (., 2. [25] |
На рис. 4, а, б приведены кинетические кривые накопления гидроперекисей н-декана ( а) и кумола ( б) на неглубоких стадиях реакции ( 3 - 5 % превращения), когда концентрация углеводорода равна исходной. [26]
 |
Кинетические кривые выхода ГПК в углеводородной ( а и водной. [27] |
Значение водной фазы в эмульсионном окислении кумола и других углеводородов особенно возрастает, как показывает опыт, в присутствии коллоидных электролитов ( эмульгаторов), содержащих поверхностно-активный анион. На рис. 2 приведены кинетические кривые накопления гидроперекиси кумола ( ГПК) в присутствии различных эмульгаторов, Как видно из этих данных, при прочих равных условиях эмульгаторы ускоряют образование гидроперекиси. Роль эмульгаторов в этом случае не может быть полностью сведена к простому стабилизированию эмульсий, так как различие в природе эмульгаторов лишь немного изменяет степень дисперсности эмульсий, в то время как скорость накопления гидроперекиси меняется значительно. [28]
Действительно, резкое замедление процессов медленного окисления наблюдается при окислении ряда углеводородов в газовой фазе ( СН4, С2Нв, С2Н4, С2Н2, С3Н8, С3Нв) при уменьшении диаметра сосуда ниже определенного критического значения, а также при окислении углеводородов в жидкой фазе в присутствии ингибиторов, при увеличении концентрации ингибитора выше критического значения. В качестве иллюстрации на рис. 96 приведены кинетические кривые накопления гидроперекиси при окислении н-декана при 1 30 С в присутствии различных концентраций а-нафтола. Видно, что при изменении концентрации а-нафтола от 3, Ы0 - 7 до 3 3 - Ю-7 Ml л происходит резкий переход от быстрого окисления к практически полной остановке реакции. [29]
При выводе кинетических уравнений для образования гидроперекиси предполагалось, что стационарная концентрация свободных радикалов устанавливается практически мгновенно. Это приводит к появлению затянутых периодов индукции на кинетических кривых накопления гидроперекиси. [30]
Страницы: 1 2