Железопорфирин
Cтраница 1
Железопорфирин может обратимо отщепляться от пероксидазы хрена и цитохром с-пероксидазы без денатурации белка, причем нативный фермент реконструируется без утраты активности. Правда, отделение железопорфирина от каталазы до сих пор не удается провести обратимо. [1]
Для железопорфиринов нет надежных данных о влиянии замены аксиального лиганда на скорость замещения другого лиганда независимо от наличия или отсутствия белка. [2]
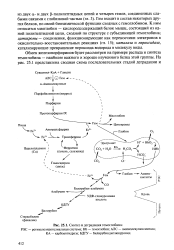 |
Синтез и деградация гемоглобина. [3] |
Обмен железопорфиринов будет рассмотрен на примере распада и синтеза гемоглобина - наиболее важного и хорошо изученного белка этой группы. [4]
Строение железопорфирина цитохрома с приведено на фиг. Обнаружено, что химические и физические свойства белковой части цитохрома с, выделенного из ряда разных тканей, очень сходны. Определена также последовательность аминокислот в полученном из ряда тканей белке, соединенном с железопорфирином. Хотя в белках, выделенных из разных тканей, имеются небольшие различия, последовательность аминокислот у них в основном одна и та же. Предполагаемое строение цитохрома с схематически показано на фиг. [5]
Химические свойства железопорфиринов определяются ароматическим характером порфиринового кольца, координационной ненасыщенностью ( железо, имеющее шесть координационных мест, связано лишь с четырьмя атомами азота порфиринового кольца) и характером замещающих групп. [6]
Важные стереохимические свойства железопорфирина в гемопротеинах были установлены на основе рентгеноструктурного анализа высокого разрешения модельных низкомолекулярных ме-таллопорфириновых комплексов. Эти данные были получены при подробном кристаллографическом исследовании комплексов пор-фиринов с ионами металлов, имеющими неодинаковые ионные радиусы, и железопорфириновых комплексов в различных спиновых состояниях. Для последующего обсуждения необходимо привести лишь те данные, которые относятся к стереохимии железопорфирина в гемопротеинах. Радиус центральной полости, ограниченной пиррольными атомами азота, определяется электронной структурой ядра порфина и остается практически постоянным. [7]
Изменения в стереохимии железопорфирина, сопровождающие изменение спинового состояния гемового железа, не были зарегистрированы в ранних исследованиях разностным методом Фурье производных миоглобина кашалота. Учитывая, что для ряда кристаллических белков разностный метод Фурье дал отличные результаты, отсутствие изменений в стереохимии железопорфирина, наблюдавшегося в молекулах типа гемоглобина, в случае миоглобина может быть обусловлено недостаточной точностью данных. [8]
Передачу изменений стереохимии железопорфирина более отдаленным областям белка через изменение ориентации порфирина с точки зрения структуры можно легко представить, учитывая данные рентгеноструктурного анализа [16, 99], касающиеся окружения гемовых групп. В области гемовой группы имеется около 60 атомов соседних аминокислотных остатков, которые связаны силами Ван-дер - Ваальса с атомами углерода каркаса порфирина. Вращательное изменение ориентации порфирина на 4 соответствует сдвигу положения ядер углеродов на периферии порфиринового кольца приблизительно на 30 пм. Такое структурное изменение легко может привести к конформационным изменениям третичной структуры ближайшего белкового окружения. Эти данные, следовательно, предполагают, что изменение ориентации порфирина на величину, наблюдаемую в спектроскопических исследованиях [133, 136], должно сопровождаться изменениями третичной структуры белка. Такие структурные изменения, происходящие, например, при отщеплении или связывании кислорода, могут затем передаваться к более отдаленным областям белковых субъединиц, таких, как контактные области at - P2 ( рис. 2), посредством несвязывающих взаимодействий между каркасом порфирина и боковыми цепями аминокислот в ближайшем окружении тема. [9]
В отличие от железопорфиринов - гемоглобина и цитохромов - в основе хлорофиллов лежит магниевый комплекс частично гидрированного порфинового ядра - дигидропорфина или хлорина. [10]
Гемоглобин и миоглобин - комплексы железопорфиринов с белками, выполняющие функцию фиксации и транспорта молекулярного кислорода в организмах животных. Цитохромы, имеющие аналогичную принципиальную структуру, выполняющие роль переносчика электрона в схемах фотосинтеза, дыхания, окислительного фос-форилирования и др. окислительно-восстановительных реакциях, найдены у всех животных, растений и микроорганизмов. Хлорофиллы - главные участники процессов фотосинтеза - содержатся в высших растениях, водорослях и фотосинтезирующих бактериях. [11]
Необходимо подчеркнуть, однако, что изменения стереохимии железопорфирина в миоглобине значительно меньше, чем изменения, наблюдаемые в молекуле гемоглобина. Хотя невозможно сделать количественную оценку вкладов различных ошибок, например неточности нахождения фаз при определении стереохимии тема в миоглобине кашалота по сравнению с аналогичными эффектами в многочисленных исследованиях гемоглобина, данные рентгенострук-турного анализа свидетельствуют о том, что конфигурационные и стереохимические изменения тема ярче выражены в гемоглобине. Падлан [95] и Падлан и Лав [97] наблюдали изменения стереохимии железопорфирина при изменении спинового состояния, рассчитанные разностным методом Фурье только для центросиммет-ричной проекции с разрешением 300 пм - для мономерного гемоглобина glycera. При изучении проекций разностным методом Фурье в случае миоглобина кашалота с разрешением 280 пм [92] не наблюдалось практически никаких изменений. Кроме того, хотя изменений величин смещения атома железа из плоскости порфирина для метэритрокруорина и дезоксиэритрокруорина не ожидалось, тем не менее трехмерным разностным методом Фурье с разрешением 250 пм [96] были обнаружены изменения стереохимии железопорфирина и конфигурации порфирина при связывании окиси углерода дезоксипроизводным. Возможно, что более выраженная тенденция к меньшим изменениям стереохимии гемовой группы при изменении состояния окисления и лигандного окружения иона железа в миоглобине отражает фундаментальные свойства структуры, отличающие миоглобины от молекул типа гемоглобина. Тенденция к неизменности плоскостной структуры порфирина в миоглобине кашалота была недавно подтверждена спектроскопическими исследованиями. Более подробно результаты этих исследований будут обсуждены ниже ( разд. [12]
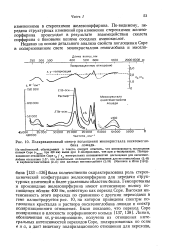 |
Поляризационный спектр поглощения монокристалла оксигемоглобина лошади. [13] |
По-видимому, передача структурных изменений при изменении стереохимии железопорфирина происходит в результате взаимодействия скелета порфирина с боковыми цепями соседних аминокислот. [14]
В противоположность этому на пути исследования небелковых комплексов железопорфиринов встречаются определенные трудности. Они очень плохо растворимы в воде, за исключением сильнокислых или сильнощелочных растворов, и склонны к образованию димеров и, возможно, агрегатов с более высоким молекулярным весом. В связи с этим получено сравнительно мало надежных данных по константам связывания аксиальных лигандов. Растворы же-лезопротопорфирина чувствительны к воздуху, по-видимому, из-за реакции автоокисления винильной боковой цепи и быстро разрушаются в присутствии перекиси водорода. Данные, которые иногда приводят для протопорфиринового комплекса, могут в действительности относиться к продукту его автоокисления. По всем этим причинам для прямого количественного сравнения со свойствами ферментов во многих случаях не хватает именно корректных термодинамических и кинетических данных о небелковых железопорфириновых комплексах. [15]
Страницы: 1 2 3 4