Железопорфирин
Cтраница 2
Имеется ряд данных, позволяющих сравнить свойства перокси-дазы хрена и небелковых железопорфиринов. По кинетическим данным не обнаружено отклонений от ожидаемого поведения для простой одностадийной реакции. Если считать, что исходный комплекс был правильно идентифицирован как комплекс Fev ( а не FeIV), то это означает, что реакция идет в одну двухэлектронную стадию или &54 чз. [16]
В данном разделе будут рассмотрены современные представления о синтезе и распаде железопорфиринов, в частности гемоглобина-наиболее изученного хромопротеина. [17]
 |
Случай катализатора с незаполненной зоной. [18] |
Приводим численные результаты для случая, когда система катализатора ( молекула железопорфирина) много больше молекулярной системы реагента - перекиси водорода. При таком большом повышении уровня Ферми малой молекулы Н202 ( перенос заряда на разрыхляющий уровень) она становится неустойчивой и распадается. [19]
Гемопротеиды - сложные белки, представители хромопротеидов, простетической группой у которых является железопорфирин. [20]
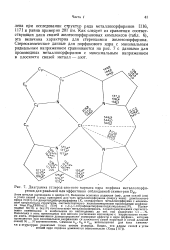 |
Диаграмма углерод-азотного каркаса ядра порфина металлопорфиринов для реальной или эффективно соблюдаемой симметрии Dt / l. [21] |
Как следует из сравнения соответствующих длин связей железопорфириновых комплексов ( табл. 6), эта величина характерна для стереохимии железопорфирина. Стереохимические данные для порфинового ядра с минимальным радиальным напряжением сравниваются на рис. 7 с данными для производных металлопорфиринов с максимальным напряжением в плоскости связей металл - азот. [22]
С точки зрения химии комплексных соединений представляется несколько странным, что аксиальные лиганды оказывают лишь слабое влияние на реакционную способность железопорфирина ( разд. [23]
Более того, поскольку для многих химически подобных комплексов Fe ( III) и Fe ( II) длины связей Fe-N различаются на - 2 пм [58], аналогично следует ожидать, что плоская структура железопорфирина реализуется и для низкоспиновых ферро-комплексов. В этом комплексе длины связей Fe-Np меньше 201 пм и наблюдается копланарное расположение атома железа и атомов азота пиррольных колец. [24]
Железопорфирин может обратимо отщепляться от пероксидазы хрена и цитохром с-пероксидазы без денатурации белка, причем нативный фермент реконструируется без утраты активности. Правда, отделение железопорфирина от каталазы до сих пор не удается провести обратимо. [25]
На второй стадии молекула белка помогает удалению экстралиганда L ( ими-дазол) и включению на его место молекулы Н2О2, которая, создавая неустойчивое переходное состояние (), окисляет координированную HOj. В результате выделяется кислород, а железопорфирин остается неизменным в своей активной форме. [26]
Карты разностной электронной плотности Фурье оксимиоглобина относительно метмиоглобина с разрешением 280 пм были рассчитаны затем в трех измерениях. Результирующая карта электронной плотности не обнаруживает никаких изменений в стереохимии железопорфирина. Однако эти результаты можно рассматривать лишь как подтверждающие реализацию геометрии Полин-га при связывании кислорода в миоглобине. Уотсон и Ноббс [142] указывают, что при рентгеновском облучении в процессе получения данных ускоряется окисление оксигенированных производных. В работе [142] не приводится данных относительно начальных и конечных концентраций окисленных производных миоглобина и концентраций оксимиоглобина в исследуемых кристаллах. [27]
Создание в результате эволюции белков, способных связывать кислород - хороший пример решения проблемы кооординацион-ной химии, причем природа отыскала несколько таких решений. Кофактором или простетической группой, которая связывает кислород, могут быть железопорфирин, негемовое железо, медь или, по-видимому, даже ванадий. Природа лигандов известна только в случае железопорфиринов ( разд. Кроме того, железопорфи-рин гемоглобина и миоглсбика можно заменить кобальтпсрфири-новым аналогом с образованием функционально активных аналогов гемоглобина и миоглобина, откуда следует, что природа ке исчерпала всех возможностей в использовании имеющихся в ее распоряжении металлов, акикокислот и лигандов ( разд. [28]
Структурные данные четко свидетельствуют о том, что стереохимические изменения железо-порфирина в гемопротеинах связаны с переходами спинового состояния центрального координированного иона металла. Однако из-за отсутствия достаточно точных стереохимических данных невозможно сделать каких-либо количественных оценок относительного вклада изменений структуры железопорфирина по сравнению с постулированным изменением длины связи Fe-Мимидазол. Несомненно, таким количественным оценкам препятствует тот факт, что дезоксигемоглобин и координированные тетрамерные гемогло-бины млекопитающих кристаллизуются в различных пространственных группах симметрии [113], вследствие чего невозможно прямое сопоставление соответствующих четвертичных структур, например, разностным методом Фурье. Кроме того, было постулировано [103, 128], что оба конформационных события носят три-герный характер и инициируют изменение четвертичной структуры при отщеплении или связывании молекулы кислорода вследствие изменений в F-спирали субъединиц белка, содержащих координирующий остаток гистидина. Предполагается, что это изменение структуры распространяется, на другие области белка. Однако природа изменений в F-спирали пока не ясна. [29]
Изменения в стереохимии железопорфирина, сопровождающие изменение спинового состояния гемового железа, не были зарегистрированы в ранних исследованиях разностным методом Фурье производных миоглобина кашалота. Учитывая, что для ряда кристаллических белков разностный метод Фурье дал отличные результаты, отсутствие изменений в стереохимии железопорфирина, наблюдавшегося в молекулах типа гемоглобина, в случае миоглобина может быть обусловлено недостаточной точностью данных. [30]
Страницы: 1 2 3 4