Постоянная жесткость - вода
Cтраница 2
Этим методом определяют именно постоянную жесткость воды, а не общую, так как на осаждение карбонатов кальция и магния, присутствующих в воде в виде гидрокарбонатов, Na2CO3 не расходуется. Для определения жесткости воды в последнее время успешно применяют комплексонометрические методы. [16]
Как временная, так и постоянная жесткость воды может быть устранена прибавлением к воде соды. Можно ли заменить соду: а) карбонатом калия; б) гидроокисью бария, которая хорошо растворима в воде. [17]
Содовый, фосфатный способы удаления постоянной жесткости воды. [18]
Ниже будет рассмотрено отдельно ацидиметрическое определение карбонатной и постоянной жесткости воды. [19]
Содовый, известковый, щелочной спосооы удаления постоянной жесткости воды. [20]
Коагулирование воды имеет и отрицательную сторону: оно повышает постоянную жесткость воды вследствие перехода некоторого количества бикарбонатов в сульфаты. [21]
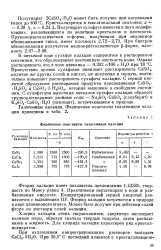 |
Физические константы галогенидов кальция. [22] |
В питьевой воде сульфат кальция содержится в растворенном состоянии, что обусловливает постоянную жесткость воды. Однако растворимость его в воде невелика - 0 202 г / 100 г Н20 при 18 С. Присутствие прочих сульфатов понижает растворимость CaS04, наличие же других солей и кислот, не исключая и серную, значительно повышает растворимость сульфата кальция. С серной кислотой образуются растворимые продукты присоединения CaS04 - H2S04 и GaS04 - 3 H2S04, которые выделены в свободном состоянии. С сульфатами щелочных металлов сульфат кальция образует труднорастворимые двойные соли - Na2S04 - CaS04 ( глауберит) и K2S04 - GaS04 - H20 ( сингенит), встречающиеся в природе. [23]
В питьевой воде сульфат кальция содержится в растворенном состоянии, что обусловливает постоянную жесткость воды. Однако растворимость его в воде невелика - 0 202 г / 100 г Н20 при 18 С. Присутствие прочих сульфатов понижает растворимость CaS04, наличие же других солей и кислот, не исключая и серную, значительно повышает растворимость сульфата кальция. С серной кислотой образуются растворимые продукты присоединения CaS04 - H2S04 и GaS04 - 3 H2S04, которые выделены в свободном состоянии. С сульфатами щелочных металлов сульфат кальция образует труднорастворимые двойные соли - Na2S04 - CaS04 ( глауберит) и K. [24]
Хлориды и сульфаты при кипячении воды не изменяются и остаются в растворе, а поэтому этим путем постоянная жесткость воды не может быть устранена. [25]
Сернокислые и хлористые соли в кипящей воде не изменяются и остаются в растворе, а потому этим путем постоянная жесткость воды не может быть устранена. [26]
Недостатком использования коагулянтов для локального осветления сточных вод является неизбежное увеличение солесодер-жания в осветленной воде либо снижение щелочности за счет роста постоянной жесткости воды вследствие реакции анионов коагулянтов с растворенными в воде бикарбонатами кальция и магния. [27]
Различают временную ( карбонатную) жесткость воды, обусловленную наличием в воде гидрокарбонатов кальция Са ( НСОзЬ и магния Mg ( HCO3) 2, и постоянную жесткость воды, обусловленную наличием в воде сульфатов кальция и магния CaSO4, MgSO4, хлоридов кальция и магния СаСЬ, MgCb и других солей. [28]
Некарбонатная жесткость определяется содержанием в воде сульфатов или хлоридов кальция и магния, которые не переводятся в осадок кипячением, и поэтому некарбонатную жесткость воды называют постоянной жесткостью воды. [29]
Одной из важных для технических целей характеристик качества воды является величина ее так называемой постоянной жесткости. Постоянная жесткость воды характеризует ту жесткость, которая остается в воде после кипячения. [30]
Страницы: 1 2 3