Нарастание - металлические свойство
Cтраница 3
Физические и химические свойства элементов подгруппы азота изменяются с увеличением порядкового номера в той же последо вательности, которая наблюдалась в ранее рассмотренных труп пах. Но так как неметаллические свойства выражены у азота сла бее, чем у кислорода и тем более фтора, то ослабление этих свойств при переходе к следующим элементам влечет за собой появление и нарастание металлических свойств. [31]
Галлий, индий и таллий входят в IIIA-подгруппу периодической системы. По этому признаку галлий, индий и таллий аналогичны алюминию и бору, что и дало основание помещать их вместе в главную подгруппу III группы. Однако строго последовательного нарастания металлических свойств от бора к таллию не наблюдается: резко усиливаясь от бора к алюминию, они затем уменьшаются у галлия и вновь незначительно возрастают при переходе к таллию. Такое незакономерное изменение металлических свойств связано с тем, что в атомах галлия, индия и таллия в предпоследнем электронном уровне содержится по 18 электронов в отличие от атома алюминия, содержащего в предпоследнем уровне 8 электронов. В этом отношении более сходными с алюминием являются элементы ШВ-подгруппы - скандий, иттрий, лантан и актиний, которые вместе с алюминием и бором укладываются в ряд с закономерным плавным нарастанием металлических свойств. [32]
Между тем, по своему положению в системе Менделеева франций представляет очень большой интерес в химическом отношении. Он стоит в первой группе периодической системы, в подгруппе активнейших - щелочных металлов. При этом вследствие нарастания металлических свойств от более легких к более тяжелым элементам франций должен быть самым активным металлом среди всех элементов. [33]
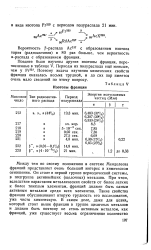 |
Изотопы франция. [34] |
Между тем по своему положению в системе Менделеева франций представляет очень большой интерес в химическом отношении. Он стоит в первой группе периодической системы, в подгруппе активнейших ( щелочных) металлов. При этом, вследствие нарастания металлических свойств от более легких к более тяжелым элементам, франций должен быть самым активным металлом среди всех элементов. Такие свойства франция обусловливают вторую трудность его исследования, уже чисто химическую. [35]
Для висмута, кроме того, в паровой фазе известны и все моногало-гениды В1Г, также склонные к диспропорционированию. Подобные низшие соединения для сурьмы малохарактерны, а для мышьяка неизвестны. Это находится в полном соответствии с нарастанием металлических свойств в рассматриваемом ряду. [36]
Аналогичный характер изменения свойств наблюдается у элементов третьего периода, а также у s - и р-элементов всех последующих периодов. Однако ослабление прочности связи внешних электронов с ядром у элементов главных подгрупп по мере роста Z определенным образом сказывается на их свойствах. Так, у р-элементов одной и той же группы отмечается нарастание металлических свойств. В VIII главной подгруппе ослабляется устойчивость конфигурации ns2n / 76 ( по мере увеличения п), вследствие чего уже криптон Кг ( четвертый период) приобретает способность образовывать химические соединения. [37]
Аналогичный характер изменения свойств наблюдается у элементов третьего периода, а также у s - и р-элементов всех последующих периодов. Однако ослабление прочности связи внешних электронов с ядром у элементов главных подгрупп по мере роста Z определенным образом сказывается на их свойствах. Так, у / 7-элементов одной и той же группы отмечается нарастание металлических свойств. В главной подгруппе VIII группы ослабляется устойчивость конфигурации ns2np6 ( по мере увеличения п), вследствие чего уже криптон Кг ( четвертый период) приобретает способность образовывать химические соединения. [38]
Рассмотрение периодической системы элементов обнаружило, что, кроме классической менделеевской периодичности, наблюдаются и другие виды периодичности. Сперва рассмотрим так называемую внутреннюю периодичность. Этот вид периодичности наблюдается в пределах больших периодов, где в их средних частях наблюдается временное нарастание металлических свойств, при этом максимумы проявления металлических химических свойств приходятся на медь, серебро и золото. Таким образом, внутри каждого большого периода наблюдается как бы своя периодичность. Вторым примером внутренней периодичности является закономерность, наблюдаемая в группе лантаноидов. [39]
Элемент № 85 расположен в периодической системе в подгруппе галогенов седыйой группы: фтор - хлор - бром - иод. Таким образом, он является пятым членом группы активнейших неметаллов. Однако закон Менделеева приводит к выводу, что при переходе в пределах данной группы от более легких элементов к более тяжелым наблюдается систематическое нарастание металлических свойств. Поэтому элемент № 85 должен был представить существенный интерес как промежуточный по своим химическим свойствам между металлами и типичными неметаллами. [40]
Это замещение возможно вплоть до германохлороформа GeHCl3 и тетрахлорида германия GeC. Таким образом, в силу малой разности ОЭО и преимущественно ковалентного характера связи в германах понятие степени окисления является сугубо формальным и не поддающимся однозначному определению. Своеобразие свойств гидридов германия еще раз подтверждает шфотер-иость этого элемента. Принимая во внимание нарастание металлических свойств в ряду Ge-Sn-Pb, отметим, что олово в гидридах является преимущественно катионообразователем. При этом, однако, следует иметь в виду, что все эти фазы являются металлидами. В еще большей степени это характерно для свинца. [41]
Таким образом, азот в главной подгруппе V группы занимает особое место. Мышьяк, сурьма и ннсмуг образуют соединения, по свойствам более близкие к аналогичным соединениям фосфора. Однако нарастание металлических свойств в группе сверху, вниз сказывается на общем характере изменения свойств соединений. Например, устойчивость водородных соединений в ряду РН - Aslia - ЗЬНз продолжает уменьшаться. Кислотный характер диссоциации гидроксндов, соответствующих высшим оксидам, и их устойчивость при переходе от фосфора к висмуту уменьшаются. [42]
Литий может только внедряться в кристаллические решетки германия и кремния и создавать донорные уровни. Энергия активации примесных атомов IIIА и VA подгрупп в германии значительно меньше, чем в кремнии. Интересно, что энергия активации акцепторов III группы увеличивается от бора к индию. Это объясняется нарастанием металлических свойств элементов от В к In, вследствие чего способность к захвату электронов падает. Отсюда растет энергия активации акцептора. В заключение заметим, что полупроводники, в которые введена какая-либо примесь при определенной температуре, могут оказаться в неравновесном состоянии при рабочей температуре прибора. Это состояние может сохраняться ( иногда долго при низкой температуре - ложное равновесие) или медленно изменяться, потому что процессы в твердых телах требуют значительной энергии активации. В результате теряется надежность устройства, так как изменяются его параметры. Все сказанное выдвигает определенные требования, касающиеся условий и методов приготовления полупроводников, пригодных для обеспечения надежной работы приборов. [43]
Это объясняется заметным уплотнением электронной оболочки тантала за счет ярко выраженного эффекта проникновения бз-электронов под экран из 4 / 14-электронов. Однако вторые потенциалы ионизации в этом ряду монотонно уменьшаются, что можно объяснить относительным уменьшением прочности связи оставшегося неспаренного s - электрона с ядром. В целом оказывается, что сумма первых двух потенциалов ионизации у ванадия заметно больше ( 21 87 В), чем у ниобия и тантала ( 20 36; 20 58 В соответственно), а у последних эти характеристики практически совпадают. Сравнивая последующие потенциалы ионизации, отметим, что / 3, / 4, / 5 уменьшаются в ряду V-Nb - Та. Это приводит и к уменьшению в этом же направлении суммы пяти потенциалов ионизации. Последнее обстоятельство и объясняет, с одной стороны, увеличение стабильности высшей степени окисления при переходе от ванадия к танталу, а с другой стороны, нарастание металлических свойств В степени окисления 5 в том же направлении, что вообще характерно для многих d - элементов. Последнее обстоятельство подтверждается и изменением электроотрицателыюсти, которая несколько уменьшается при переходе от ванадия к ниобию и танталу. [44]
Страницы: 1 2 3