Ограниченно растворимая жидкость
Cтраница 2
Простейшим примером могут служить системы, составленные из двух взаимно ограниченно растворимых жидкостей. Эти системы состоят из двух фаз: насыщенного раствора второго компо нента в первом и насыщенного раствора первого компонента во втором. Состав насыщенных равновесных растворов зависит от температуры и давления. Однако для заметного изменения взаимной растворимости двух жидкостей при постоянной температуре необходимо прибегать к довольно большим давлениям. [16]
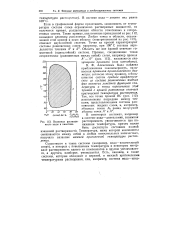 |
Взаимная раствори мость воды и никотина. [17] |
Если в графической форме представить зависимость от температуры состава слоев ограниченно растворимых жидкостей, то получится кривая, разделяющая области гомогенных и гетерогенных систем. Такие кривые, аналогичные приведенной на рис. 112, называют кривыми расслоения. Любая точка в области, ограниченной этой кривой и осью абсцисс ( заштрихованной на рис. 112), отвечает двухслойной системе. Область же вне кривой отвечает гомогенной ( однослойной) системе. [18]
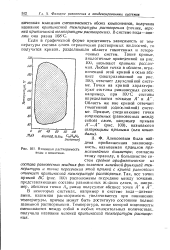 |
Взаимная растворимость воды и никотина. [19] |
Если в графической форме представить зависимость от температуры состава слоев ограниченно растворимых жидкостей, то получится кривая, разделяющая области гомогенных и гетерогенных систем. Такие кривые, аналогичные приведенной на рис. 100, называют кривыми расслоения. Любая точка в области, ограниченной этой кривой и осью абсцисс ( заштрихованной на рис. 100), отвечает двухслойной системе. Область же вне кривой отвечает гомогенной ( однослойной) системе. [20]
Простейшим примером могут служить системы, составленные из двух взаимно ограниченно растворимых жидкостей. Эти системы состоят из двух фаз: насыщенного раствора второго компонента в первом и насыщенного раствора первого компонента во втором. Состав насыщенных равновесных растворов зависит от температуры и давления. Однако для заметного изменения взаимной растворимости двух жидкостей при постоянной температуре необходимо прибегать к довольно большим давлениям. Поэтому практическое значение имеет главным образом зависимость взаимной растворимости от температуры при постоянном давлении. [21]
Простейшим примером самопроизвольно образующихся термодинамически устойчивых дисперсных гетерогенных систем являются смеси ограниченно растворимых жидкостей, например, вода - фенол при температурах, близких к критическим температурам их абсолютного смешения. По мере приближения к критической температуре фазы становятся близкими по составу, а межфазное натяжение уменьшается. При определенной температуре межфазное натяжение достигает такого малого значения, при котором поверхностная энергия будет скомпенсирована энтропийной составляющей. Самопроизвольно образуется эмульсия, частицы которой под действием молекулярно-кинетического движения равномерно распределяются по всему объему системы. При этом распределение частиц по размерам, как было показано Фольмером, должно соответствовать больцмановскому распределению и определяется значением поверхностной энергии. [22]
Простейшим примером самопроизвольно образующихся термодинамически устойчивых дисперсных гетерогенных систем являются смеси ограниченно растворимых жидкостей, например вода - фенол, при температурах, близких к критическим температурам их абсолютного смешения. По мере приближения к критической температуре фазы становятся близкими по составу, а межфазное натяжение уменьшается. При определенной температуре межфазное натяжение достигает такого малого значения, при котором поверхностная энергия будет скомпенсирована энтропийной составляющей. Самопроизвольно образуется эмульсия, частицы которой под действием теплового движения равномерно распределяются по всему объему системы. При этом распределение частиц по размерам, как было показано Фольмером, должно соответствовать больцмановскому распределению и определяется значением поверхностной энергии. [23]
При этом различают системы с одной, двумя и тремя парами ограниченно растворимых жидкостей. В диаграмме равновесия ( рис. IX-7, а) точки D и Е соответствуют насыщенным растворам Л С. [25]
Исключение представляют так называемые критические эмульсии, образующиеся из критических смесей двух ограниченно растворимых жидкостей, например, воды и фенола, при небольшом охлаждении этих смесей, так, чтобы их температура была лишь на 1 - 2 ниже критической температуры смешения. В этих условиях возможно самопроизвольное эмульгирование одной жидкости в другой и получение термодинамически устойчивой критической эмульсии. [26]
 |
Диаграмма температура кипения - состав ограниченно растворимых жидкостей. [27] |
На рис. 10.6 изображен один из типов диаграмм температура кипения - состав бинарной жидкой смеси ограниченно растворимых жидкостей при Р const. В зависимости от температуры и общего состава смеси в системе может существовать либо одна жидкая фаза ( раствор Ж или Жа), либо обе жидкие фазы одновременно. Равновесие жидкости и насыщенного пара при кипении однофазной жидкости характеризуется в этом случае интервалом температур, в котором жидкость и пар изменяют свой состав. Количество насыщенного пара и равновесной жидкости определяется положением точки суммарного состава смеси по правилу рычага. [28]
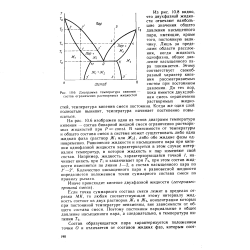 |
Диаграмма температура кипения - состав ограниченно растворимых жидкостей. [29] |
На рис. 10.6 изображен один из типов диаграмм температура кипения - состав бинарной жидкой смеси ограниченно растворимых жидкостей при Р const. В зависимости от температуры и общего состава смеси в системе может существовать либо одна жидкая фаза ( раствор Ж или Жг), либо обе жидкие фазы одновременно. Равновесие жидкости и насыщенного пара при кипении однофазной жидкости характеризуется в этом случае интервалом температур, в котором жидкость и пар изменяют свой состав. Количество насыщенного пара и равновесной жидкости определяется положением точки суммарного состава смеси по правилу рычага. [30]
Страницы: 1 2 3 4
