Нативный белок
Cтраница 1
Нативный белок существует в водной среде, поэтому полярные группы R аминокислотных остатков располагаются на поверхности глобулы и взаимодействуют с водой, а неполярные R спрятаны внутрь глобулы и контактируют между собой. Аналогичная ситуация может возникнуть и в модельных полипептидах: если растворитель полярный ( вода), то полярные группировки R аминокислотных остатков стремятся оказаться снаружи, в неполярных растворителях следует ожидать противоположного - неполярные группировки R аминокислотных остатков будут стремиться оказаться на поверхности. [1]
Нативный белок существует в водной среде, и природа как бы решает оптимальную задачу - полярные аминокислоты располагаются на поверхности глобулы и взаимодействуют с водой, а неполярные - спрятаны внутрь глобулы и контактируют между собой. Аналогичная ситуация может возникнуть и в полипептидах: если растворитель полярный ( вода), то полярные аминокислоты стремятся оказаться снаружи; в неполярных растворителях следует ожидать противоположного - неполярные аминокислоты будут стремиться оказаться на поверхности. [2]
KD процесса нативный белок денатурированный белок минимальна. [3]
Цифры показывают также, что реакция нативный белок - - денатурированный белок сопровождается возрастанием энтропии, доходящим до 180 кал / град моль. Это значительное возрастание энтропии и является, очевидно, движущей силой денатурации, так как в результате этого процесса F при повышении температуры становится отрицательной величиной и денатурация начинает протекать с повышенной скоростью. [4]
Денатурация, по-видимому, характеризуется некоторым общим расслаблением довольно жестко закрепленных структурных отношений, характеризующих нативный белок. Это приводит к раскручиванию свернутых полипептидных цепей ( стр. [5]
Во-вторых, для установления структуры белка на основе данных по дифракции рентгеновских лучей необходимо исследовать не только нативный белок, но и ряд его изоморфных производных. [6]
Определение концевых групп можно рассматривать как метод анализа нативного белка, так как в первой основной стадии реагирует нативный белок. При этом предполагается, что условия проведения этой реакции таковы, что разрушения белка не происходит. [7]
Оптическая активность белков, полисахаридов и нуклеиновых кислот обусловлена их оптически активными компонентами - аминокислотами и сахарами, а также асимметрией их вторичной структуры, имеющей форму право - или левовинтовых спиралей. Денатурированный белок имеет конформацию беспорядочного клубка и поэтому дает оптическое вращение, отличное от того, которое дает соответствующий нативный белок, содержащий спиральные участки. Оптическое вращение растворов амилопектина, имеющего в основном неспиральное строение, отличается от оптического вращения свежеприготовленной спиральной амилозы, если проводить сравнение в пересчете на один и тот же вес глюкозы. Изменения во вторичной структуре макромолекул удается регистрировать путем измерения удельного вращения не только по всему спектру, но и при одной длине волны. Уже с давних пор известно, что белок по мере денатурации приобретает все более и более отрицательное удельное вращение. Величины [ а ] о для полностью денатурированных белков и беспорядочно свернутых полипептидов лежат в интервале от - 90 до - 125, тогда как удельное вращение белков в нативном состоянии составляет 100 и больше. Изменения конформации белков, обусловленные изменением рН, также отражаются на величине удельного вращения. Все эти свойства белковых растворов известны по наблюдениям их удельного вращения при одной длине волны - как правило, при длине волны D-линии натрия. [8]
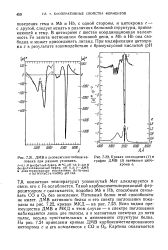 |
Кривая поглощения ( 1 и график ДМВ ( 2 нативного цитохрома с. [9] |
Мет алкилируется и связь его с Fe ослабляется. Такой карбоксиметилированный фер-роцитохром с оказывается, подобно Mb и НЬ, способным связывать СО и 02 без окисления. Нативный белок этой способности не имеет. ДМВ нативного белка и его спектр поглощения показаны на рис. 7.22, кривая МКД - на рис. 7.23. Ясно видны преимущества ДМВ и МКД в этом случае - в спектре поглощения наблюдаются лишь две полосы, а в магнитных спектрах до пяти полос, весьма чувствительных к изменениям структуры белка. [10]
Боррелии грамотрицательны, хорошо окрашиваются анилиновыми красителями. При окраске по Романовскому - Гимзе становятся сине-фиолетовыми. Растут на жидких питательных средах, содержащих нативный белок и кусочки тканей, и на куриных эмбрионах, лучше в анаэробных условиях, при температуре 35 С, вырастают к 4 - 7 ч культивирования и обнаруживаются в темном поле. Возбудители возвратного тифа быстро погибают при температуре до 50 С и высушивании, а замораживание при - 8 С переносят хорошо в течение нескольких месяцев. [11]
 |
Свойства лизоцима Т4 и шести его вариантов, полученных с помощью генной инженерии1. [12] |
Чтобы определить, в какие участки полипептидной цепи могут быть введены одна, две или три дисульфидных связи для стабилизации фермента без нарушения его каталитической активности, использовали компьютерное моделирование пространственной структуры ксиланазы. Были получены восемь производных ксиланазы В. Все они обладали более высокой термостабильностью, чем нативный фермент, и при этом три были столь же активны при 60 С, как и нативный белок, а один, содержащий ди-сульфидную связь между N - и С-концами, был даже в два раза более активным и сохранял свыше 85 % своей активности после 2-часовой инкубации при 60 С, в то время как нативный фермент полностью утрачивал активность в этих условиях уже через 30 мин. [13]
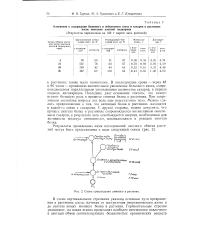 |
Схема превращения аммиака в растении. [14] |
В последующие сроки - через 48 и 96 часов - произошло значительное увеличение белкового азота, сопровождающееся параллельным уменьшением количества Сахаров, в первую очередь дисахаридов. Последнее дает основание считать, что сахаря играют большую роль в процессе синтеза белка в растениях. При современном состоянии вопроса эта роль еще недостаточно ясна. Можно сделать предположение о том, что нативный белок в растениях находится в какой-то связи с сахарами. С другой стороны, можно допустить, что процесс синтеза белка в растениях сопровождается интенсивным окислением Сахаров, в результате чего освобождается энергия, необходимая для активности молекул аминокислот, вовлекающихся в реакции синтеза белка. [15]
Страницы: 1 2