Секреторные белок
Cтраница 1
Секреторные белки, накапливающиеся в межмембранном просвете ( цистерновом пространстве) эндоплазматического ретикулума, далее транспортируются к аппарату Гольджи, концентрируются в секреторных гранулах и, наконец, выводятся посредством механизма экзоцитоза. [1]
Синтез секреторных белков в культуре эпителиальных клеток поджелудочной железы специфично подавляется актиномици-ном - D - антибиотиком, блокирующим синтез РНК. [3]
Более того, хотя синтез мембранных и секреторных белков происходит на мембраносвязанных рибосомах, инициация их трансляции совершается на свободных частицах: нативные 40S частицы, начинающие инициацию, всегда свободны, и образующиеся в результате инициации 80S частицы также еще не прикреплены к мембранам. [5]
Аминокислотной последовательности интерферона предшествует типичная для секреторных белков сигнальная последовательность, селективно отщепляемая во время или сразу после прохождения мембраны. [6]
Уже давно было отмечено, что свободные полирибосомы продуцируют в основном водорастворимые белки для внутренних потребностей самой цитоплазмы, в то время как мембраносвязан-ные частицы синтезируют либо белки для мембран, либо секреторные белки, выводимые через мембраны из клетки. Очевидно, что растворимые цитоплазматические белки, синтезируемые на свободных полирибосомах, сворачиваются по мере выхода из рибосомы в водном окружении, в результате формируя типичную глобулярную структуру с гидрофобным ядром внутри и более или менее полярной поверхностью. [7]
 |
Освобождение белка из рибосомы. [8] |
Процесс закручивания полипептидной цепи происходит при помощи специальных белков - шапиронов ( гл. При синтезе мембранных и секреторных белков, начиная с Ж - конца полипептидной цепи, от 10 до 30 аминокислотных остатков образуют сигнальную последовательность, состоящую из гидрофобных аминокислот. В клетках существуют свободные и мембранно-свя-занные рибосомы, причем связывание их с мембраной ЭР определяется в основном сигнальной последовательностью растущего полипептида. В мембранах ЭР найдены два гликопротеина, получившие название рибофорины, которые специфически соединяются с сигнальной последовательностью полипептида. Это присоединение имеет более сложный характер. Оказалось, что в цитоплазме присутствуют специальные сигналузнающие структуры ( СУС), представляющие собой 1 IS рибонуклеопротеины. Они взаимодействуют с сигнальной последовательностью растущего полипептида, при этом элонгация временно прекращается. Синтезирующийся полипептид с СУС присоединяется к рибофоринам в мембране ЭР; при этом образуется мембранный канал, который иногда называют транслоконом. Элонгация возобновляется, но теперь она сопряжена с перемещением пептида через мембрану ЭР. После завершения синтеза полипептидной цепи под действием протеазы, которая носит название сигналаза, сигнальная последовательность отщепляется, а новосин-тезированный белок подвергается посттрансляционным модификациям или процессингу. Для большинства секреторных и мембранных белков процессинг сопряжен с транспортом через определенные компартменты. Так, гликозили-рование и ограниченный протеолиз начинаются уже в ЭР и продолжаются в аппарате Гольджи. Этот компартмент состоит из 12 - 15 тарелок, сложенных в стопку. Сторона, ориентированная на ЭР, называется цис-стороной, а в направлении цитоплазматической мембраны - / и / анс-стороной. Новосинтези-рованные белки поступают на цис-сторону аппарата Гольджи и перемещаются на его транс - сторону, пересекая все тарелки, причем по мере движения происходит их химическая модификация. Эта модификация имеет огромное значение, так как она, в частности, определяет следование новосинтезированного белка к месту функционирования. [9]
Очевидно, что важную роль в ко-трансляционном сворачивании белка может играть образование дисульфидных связей между цистеиновыми остатками. Дисульфидные связи, скрепляющие третичную структуру, особенно распространены у секреторных белков эукариот. Наоборот, внутриклеточные белки чаще характеризуются свободными сульфгидрильными группами цистеиновых остатков. Действительно, условия внеклеточной среды, по сравнению с внутриклеточной, являются более окислительными. Дисульфидные связи, по-видимому, могут завязываться между цистеиновыми остатками растущей полипептидной цепи уже по мере ее прохода через мембрану в межмембранный просвет. Такие связи могут возникать спонтанно при достаточно окислительных условиях среды. Однако, во-первых, скорость спонтанного образования дисульфидных связей в белке, по сравнению со скоростью его синтеза и сворачивания, не велика; во-вторых, в процессе сворачивания всегда существует вероятность образования дисульфидных связей между не теми остатками цистеина, которые должны образовать мостики в законченной свернутой белковой молекуле. [10]
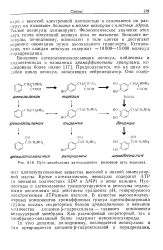 |
Пути метаболизма катехоламинов ( основной путь выделен. [11] |
Нук-леотиды и катехоламины транспортируются в везикулы отдельными носителями под действием градиента рН, генерируемого электрогенным АТРазным насосом. В качестве высокомолекулярных компонентов хромаффинных гранул идентифицирована группа кислых секреторных белков хромогранинов и меньшие количества допамин - - гидроксилазы - главного компонента везикулярной мембраны. Как растворимый секреторный, так и мембранно-связанный белок содержат мукополисахариды. [12]
Однако в случае белков, проходящих сквозь мембрану снова в водную фазу ( межмембранный просвет эндоплазматического ретикулума эукариот, периплазматическое пространство грамотрица-тельных бактерий, или вообще наружу), ситуация оказывается более сложной. Здесь, по-видимому, осуществляется многоэтапное сворачивание белка, с вовлечением ко-трансляционного и посттрансляционного процессинга полипептидной цепи и ее энзимати-ческих ковалентных модификаций. Как бы то ни было, в случае водорастворимых секреторных белков, полипептидная цепь сначала оказывается в гидрофобном окружении липидного бислоя мембраны и сворачивается, по-видимому, без формирования компактного гидрофобного ядра, а затем, по выходе из мембраны, она вынуждена перестраиваться из этой промежуточной конформации в водорастворимую глобулу с гидрофобным ядром и полярной поверхностью. [13]
Подобный же процесс, только в обратной последовательности, называется экзоцитозом. В эукариотических клетках постоянно секретируются различные типы молекул с помощью процесса экзоцитоза. Некоторые из них могут оставаться на мембране клетки и становиться ее частью, другие - выходят во внеклеточное пространство. Так, секреторные белки упаковываются в транспортные пузырьки в аппарате Гольджи и затем переносятся непосредственно к мембране. [14]
Сигнал, запускающий синтез тиреоидных гормонов, формируется в гипоталамусе в виде тиреолиберина, который, воздействуя на гипофиз, стимулирует синтез и секрецию тиреотропина. Последний взаимодействует с рецепторами на поверхности клеток щитовидной железы и опосредованно, через вторичные посредники, стимулирует синтез ряда белков, в том числе тиреоглобулин - предшественник тиреоидных гормонов. Углеводная часть составляет до 10 % от массы тиреоглобули-на. Как и все секреторные белки, тиреоглобулин синтезируется на мембран-но-связанных рибосомах, причем гликозилирование полипептидной цепи начинается в цистернах эндоплазматического ретикулума, а завершается в аппарате Гольджи. Тиреоидные гормоны являются единственной группой гормонов, для функционирования которых необходим микроэлемент иод. [15]
Страницы: 1 2