Химерный белок
Cтраница 1
 |
Очистка химерных белков, продуцируемых Е. со / / 1. [1] |
Химерный белок обладает такой же биологической активностью, что и нативный интер-лейкин-2. Однако если он предназначен для применения в клинике, то маркерный пептид необходимо удалить. [2]
Гибридный белок, химерный белок ( Fusion protein) Продукт клонированных совместно двух или более кодирующих последовательностей из разных генов. Представляет собой одну полипептидную цепь. [3]
 |
Генетически сконструированный химерный комплекс CD4 - экзотоксин A Pseudomonas. Использован промотор бактериофага Т7 Е. coli. [4] |
Затем экзотокси-новая часть химерного белка инактивирует фактор элонгации EF-2, участвующий в синтезе белка. Это препятствует дальнейшему синтезу белка, что в конце концов приводит к гибели клетки. [5]
Иммунотоксин ( Immunotoxin) Химерный белок, состоящий из двух доменов, один из которых обладает свойствами антитела, а другой - токсина. [6]
Получить разрешение на применение вакцины, содержащей химерный белок, очень трудно, поэтому, вероятно, придется субклонировать VP1 - последовательность в другом экспрессирующем векторе. Так или иначе, субъединичная вакцина против ящура скоро будет готова для проведения доклинических испытаний. [7]
 |
Создание с помощью Е. coli комбинаторной библиотеки кДНК VL - и Ун-областей антитела. [8] |
В этих случаях соответствующий фрагмент антитела синтезируется как часть химерного белка, локализованного на поверхности фаговой частицы. Суть метода состоит в следующем: образцы ( аликвоты) из библиотеки помещают в ячейки планшеты, содержащие антиген-мишень. Ячейки промывают, чтобы удалить несвязанные фаговые частицы. В каждую ячейку вносят конъюгат, состоящий из антитела, связывающегося с белком фаговой оболочки, и фермента. [9]
В некоторых случаях конечным продуктом, который предполагается использовать, является сам химерный белок. Например, нередко возникает необходимость в получении антител, узнающих конкретный участок белковой молекулы. [11]
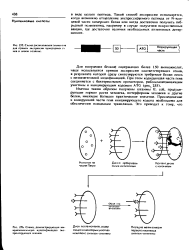 |
Схема расположения элементов для прямой экспрессии чужеродных re нов в новом хозяине.| Схема, демонстрирующая им-мунохимичеькую идентификацию экс-прессирующих клонов. [12] |
Такой способ экспрессии используется, когда возможно отщепление экспрессируемого пептида от N-koh - цевой части химерного белка или когда достаточно получить гибридный полипептид, например в случае получения искусственных вакцин, где достаточно наличия необходимых антигенных детерминант. [13]
В зависимости от предназначения белкового продукта клонированного гена он может использоваться как таковой или в составе химерного белка, причем последний вариант встречается нечасто. Например, из-за присутствия фрагмента хозяйского белка большинство химерных белков оказываются непригодными для применения в клинике, а сам продукт клонированного гена-мишени может оказаться неактивным. Кроме того, для химерных белков предусмотрена более сложная процедура тестирования, которую они должны пройти, чтобы получить разрешение к применению у соответствующих организаций. Все это заставляет искать способы удаления лишних аминокислотных последовательностей из молекулы получаемого продукта. Один из таких способов основан на присоединении белка, кодируемого геном-мишенью, к белку клетки-хозяина, содержащему короткий пептид, распознаваемый специфической протеазой небактериального происхождения. Такое присоединение тоже программируется на уровне ДНК. Олигонуклеотидные линкеры, несущие сайты для протеаз, можно пришить к клонированному гену до того, как такая конструкция будет введена в экспрессирующую векторную систему слияния. Линкером может служить, например, олигонуклеотид, кодирующий пептид Ile-Glu-Gly-Arg. [15]
Страницы: 1 2 3

