Специфические белок
Cтраница 1
Специфические белки, необходимые для инициации синтеза полипептида рибосомами. [1]
Специфические белки, необходимые для инициации синтеза полипептида в рибосомах. [2]
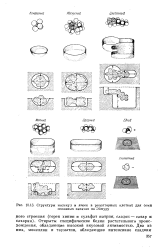 |
Структуры молекул и ячеек в рецепторных клетках для семи основных запахов по Энмуру. [3] |
Открыты специфические белки растительного происхождения, обладающие высокой вкусовой активностью. [4]
Синтез специфических белков, характерных для позвоночных животных, имеет свои особенности, которые связаны с их структурой и определяются механизмами образования de novo белковой молекулы. Ионизирующие излучения изменяют синтез специфических белков, обеспечивающих весьма важные функции организма; Нередко нарушается сопряжение синтеза составных частей сложных белковых комплексов. При лучевой болезни заметно страдают синтез некоторых соединительнотканных структур и антителообразование. Облучение крыс в дозе 167 7 мКл / кг ведет к прогрессирующему снижению включения 14С - глицина в проколлаген кожи: через 24 ч после облучения включение метки уменьшалось в 2 раза, а через 6 сут - в 5 - 6 раз. Облучение вызывает изменение нормальных соотношений белково-углеводных компонентов соединительной ткани. [5]
Ферментами называются специфические белки тканей живых организмов, выполняющие функцию биологических катализаторов. Среди ферментов имеется немало простых белков. Это однокомпонентныеферменты, такие, как пепсин, трипсин и др. Многие ферменты являются сложными белками, их молекулы содержат белковую часть и небелковую ( простетическую) группу. Такие ферменты называются двух-компонентными. К числу двухкомпонентных относятся многие ферменты окислительно-восстановительных процессов. Простетические группы ряда ферментов легко отделяются от белковой части молекулы. Такие группы называются коферментами. [6]
Любая клетка организма способна синтезировать свои специфические белки. Эта способность обусловлена генетически и передается из поколения в поколение. Информация о структуре белков содержится в ДНК. Участок молекулы ДНК, содержащий информацию о первичной структуре конкретного белка, называется геном. [7]
Ферментами, или энзимами, называются специфические белки с высоким молекулярным весом, входящие в состав клеток и тканей живых организмов и значительно ускоряющие биохимические реакции. [8]
Как уже указывалось, ферментами называются специфические белки, входящие в состав всех клеток и тканей живых организмов, играющие роль биологических катализаторов. Ферменты обусловливают способность живых организмов осуществлять необходимые для их жизнедеятельности превращения веществ. [9]
Как уже указывалось, ферментами называются специфические белки, входящие в состав всех клеток и тканей живых организмов, играющие роль биологических катализаторов. Ферменты обусловливают способность живых организмов осуществлять необходимые для их жизнедеятельности превращения веществ. Значение ферментов в процессах обмена веществ между организмом и внешней средой огромно. В частности, питание организма, усвоение им веществ внешней среды происходят при участии ферментов, находящихся в соках пищеварительного канала. [10]
Таким образом осуществляется последовательность соединения аминокислот в специфические белки, которая первично записана на определенных участках ДНК-генах. [11]
Известно, что каждый ЕИД растений синтезирует специфические белки, характеризующиеся определенным аминокислотным составом, молекулярным весом и последовательностью аминокислот. Резервуаром, откуда берутся необходимые для синтеза белков аминокислоты и куда возвращаются продукты распада белков, является небелковая фракция, главным образом фракция свободных аминокислот. Некоторые исследователи считали раньше, что аминокислотный состав синтезируемых растениями белков зависит или в какой-то степени определяется содержанием свободных аминокислот в небелковой фракции. Однако детальное изучение содержания свободных аминокислот и аминокислотного состава белков различных растений показало, что какого-либо соответствия между содержанием свободных аминокислот и аминокислотным составом белков в растениях не наблюдается; иными словами, состав небелковой фракции растений, очевидно, очень плохо приспособлен к тому, чтобы непосредственно давать необходимые для синтеза белков аминокислоты. [12]
Представление о существовании ферментов, обусловливающих образование специфических белков, как уже указывалось, не подтверждено никакими экспериментальными данными; однако в настоящее время мы не располагаем и такими экспериментальными данными, которые позволили бы окончательно его отвергнуть. Главное теоретическое возражение против этого утверждения состоит в том, что его вряд ли можно согласовать с современными физико-химическими представлениями о сущности катализа. Невозможно представить себе катализатор, который обусловливал бы синтез специфических пептидных цепей, соединяя аминокислоты в строго определенном порядке. Действие всех известных катализаторов и ферментов ограничено в каждый данный момент влиянием на одну определенную молекулярную группировку. После однократного выполнения своей функции фермент может повторно оказывать то же самое действие. Невозможно, однако, представить себе фермент, который катализировал бы, например, процесс присоединения тирозина к концевой аминной группе пептидной цепи, а затем способствовал бы присоединению аланина, глутаминовой кислоты, цистеина и других аминокислот. Все имеющиеся в нашем распоряжении данные о действии ферментов свидетельствуют о том, что фермент избирательно катализирует одну какую-либо реакцию и что характер его действия не меняется. [13]
В частности, при физиологических условиях ассоциации способствуют специфические белки, связанные с микротрубочками ( сокращение от англ, microtubule-assoeiated protein - MAP) [5], и белок сборки тубулина ( tubulin assembly protein - ТАР или Т - фактор), которые трудно отделить при очистке тубулина. Кроме того, димерная молекула тубулина содержит два GTP-связывающих центра. Ассоциация с образованием трубчатой структуры сопровождается гидролизом GTP до GDP благодаря СТРазной активности тубулина. Более легкая диссоциация комплекса GDP - тубулин указывает на важную роль этой реакции; GTP и GDP, видимо, индуцируют различные конформации тубулина, причем GTP-форма легче ассоциирует, а GDP-форма легче диссоциирует. [14]
Хроматин состоит из ДНК, РНК и ряда специфических белков. В промежутках между делениями клеток хроматин распределяется случайным образом по всему ядру, а непосредственно перед делением собирается в дискретные гранулярные тельца - хромосомы. Эукариотические клетки данного вида содержат строго определенное число хромосом; например, в соматических клетках человека имеется 46 хромосом. После репликации образовавшиеся дочерние хромосомы расходятся и попадают в дочерние клетки в результате весьма сложной последовательности событий - митоза. После завершения митоза хроматин вновь распределяется по всему ядру. [15]
Страницы: 1 2 3 4