Бензгидрилхлорид
Cтраница 1
Гидролиз бензгидрилхлорида в общем происходит так же; это же относится и к бензгидрилиденхлориду, который, однако, реагирует быстрее. Как показали Бенсли и Констэм [53], во всех случаях введение хлора уменьшает аррениусовскую энергию активации гидролиза. Эти результаты позволяют предположить, что присутствующие, помимо фенильного радикала, второй и третий атомы хлора поставляют электроны в реакционный центр, тем самым способствуя ионизации первого атома хлора и мономолекулярному характеру гидролиза. [1]
Так, бензгидрилхлорид с одной метоксильной группой в пара-положении сольволи-зуется в этаноле при 25 гораздо быстрее, чем этого можно было бы ожидать согласно уравнению Гамметта, что, очевидно, обусловлено содействием со стороны заместителя, приводящим к дополнительной стабилизации промежуточно образующегося карбониевого чона. Электронное влияние такого типа имеет относительно меньшее значение при ионизации n - метоксибензойной кислоты. [2]
При замене грег-бутилхлорида бензгидрилхлоридом выход 2 2-диарилпропана увеличивается. [3]
Изменяя соотношение реагентов и температуру, можно выделить также бензгидрилхлорид, 4-метилтрифенилметан и дибензгидриловый эфир. [4]
На графике Y - gk, например, для бензгидрилхлорида или неофилхлорида ( 1-хлор - 2-метил - 2-фенилпропан) в различных бинарных смесях для каждой смеси ( диоксан - вода, уксусная кислота - вода и этанол - вода) получается отдельная прямая, хотя при строгой подчинимости уравнению ( 100) все точки должны были бы лежать на одной прямой. Вследствие этого будто бы не зависящий от растворителя параметр m должен содержать еще один множитель, учитывающий нуклеофильность растворителя. Дело в том, что соединения, реагирующие по S - механизму, во время образования ионов в процессе активации подвергаются нуклеофильной атаке растворителем. [5]
В 20 % водном растворе этилового спирта сольволизируются трифенилхлорметан, бензгидрилхлорид и грет-бутилхлорид. [6]
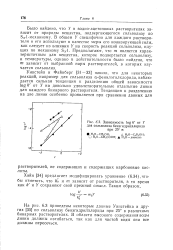 |
Зависимость log k от Y. [7] |
На рис. 6.3 приведены некоторые данные Уинстейна и других [35] по сольволизу бензгидрилхлорида при 25 в различных-бинарных растворителях. В области высокого содержания воды линии должны изгибаться, так как для чистой воды они все должны пересечься. [8]
Аналогичным образом добавление все возрастающих количеств воды часто заметно увеличивает скорость некоторых реакций, например гидролиза бензгидрилхлорида в ацетоне. [9]
Явление рекомбинации ионных пар может отчасти объяснить медленность сольволиза в уксусной кислоте бензгидрил-бромида по сравнению с бензгидрилхлоридом. Оно также отчасти объясняет медленность сольволиза этих соединений в уксусной кислоте по сравнению с сольволизом в других растворителях, в которых роль рекомбинации ионных пар менее существенна. [10]
Дифенилметан [181] К перемешиваемому раствору 3 4 г ( 90 ммолей) NaBH4 в-50 мл 80 % - ного диглима при 45 С прибавлено 2 53 г ( 12 5 ммолей бензгидрилхлорида. Реакционная смесь перемешивалась магнитной мешалкой 4 часа, по охлаждении до 25 С к смеси добавлено 20 мл пентана и затем твердый едкий натр. Анализ верхнего слоя показал, что дифенилметан ] образовался с выходом 72 % от теорет. [11]
Хотя скорость гидролиза бензгидрилхлорида в водном ацетоне не изменяется в присутствии основания, это не устраняет рассмотренной выше неопределенности, а именно выбора между механизмами SN. [12]
На ранних стадиях развития теории нуклеофильного алифатического замещения этот критерий широко применялся как доказательство мономолекулярного механизма тех гидролитических реакций галогенидов, кинетика гидролиза которых даже в щелочном растворе соответствовала первому порядку в пределах точности измерений, доступной в то время. Например, было показано, что mpe / я-бутилхлорид и бензгидрилхлорид в водном ацетоне гидролизуются по реакции примерно первого общего порядка и скорость гидролиза почти не изменяется независимо от того, в кислой, нейтральной или щелочной среде проводится реакция: в частности, реакция не ускоряется гидроксилъными ионами. [13]
Наиболее медленной стадией здесь является, как известно [36, 57], ионизация. Если бы осуществился механизм 5N2, то атака нуклеофилом ( этанолом) облегчалась бы при понижении электронной плотности на экзоциклическом углеродном атоме бензгидрилхлорида, чему, очевидно, способствовали бы электроноакцепторные заместители, и величина р была бы положительной. [14]
Уравнение Гамметта иногда утрачивает силу даже для мета - и mzpa - замещен-ных ароматических соединений. Это происходит во всех тех случаях, когда возникает возможность сильного резонансного взаимодействия между заместителем и реакционным центром. Так, бензгидрилхлорид с одной метоксильной группой в пара-положении сольволизуется в этаноле при 25 С гораздо быстрее, чем этого можно было бы ожидать согласно уравнению Гамметта, что, очевидно, обусловлено содействием со стороны заместителя, приводящим к дополнительной стабилизации промежуточно образующегося карбониевого иона. Электронное влияние такого типа имеет относительно меньшее значение при ионизации и-метоксибен-зойной кислоты. [15]
Страницы: 1 2