Неточность - уравнение
Cтраница 1
Неточности уравнений ( 18) определяются доверительным интервалом энтальпии диссоциации. Оценить неточность уравнения ( 11) не представляется возможным, однако его использование нам кажется менее желательным, поскольку AS, рассчитанные по этому уравнению, не соответствуют статистическим значениям энтропии. [1]
Неточность уравнения Ван-дер - Ваальса не является следствием каких-либо ошибочных положений, допущенных при его выводе, а вызывается лишь тем, что не были учтены некоторые добавочные физические явления, наблюдаемые в реальных газах при больших плотностях, о чем будет сказано ниже. Принципиальной ценностью уравнения Ван-дер - Ваальса является его научная обоснованность, а также то, что в основу, его вывода положены правильные физические представления о молекулярно-кинетических свойствах реальных газов и их структурных особенностях. [2]
Благодаря очевидной неточности уравнения Льюиса для смесей, кроме воды и воздуха, остается единственный путь аналогии уравнений тепло - И массообмена, многократно подтвердившихся для различных веществ. [3]
Тем самым еще раз подтверждается неточность уравнения Ван-дер - Ваальса. [4]
Столь значительное отклонение обусловлено прежде всего неточностью уравнения ( IV, 1) при очень больших давлениях. [5]
Расхождение объясняется погрешностями вычислений и ( неточностью уравнения теплового баланса. [6]
Опытными данными [55, 83] показано согласующееся с теорией [81] значительное возрастание неточности уравнения ( II) по мере протекания реакции. [7]
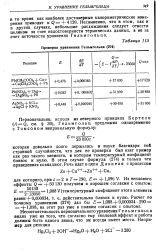 |
Проверка уравнения Гельмгольца ( 274. [8] |
Несомненно, что в этом, как и в других случаях, небольшие расхождения следует отнести целиком за счет недостоверности термических данных, а не за счет неточности уравнения Гельмгольца. [9]
Значительная аналитическая экстраполяция также необоснована: даже самые точные уравнения Ср р ( Т) могут дать не только большое отклонение от опыта, но и отсутствующие в действительности максимумы; источником погрешности может служить и неточность уравнения Ср р ( Т) в данной области температур: поэтому суммарная ошибка при вычислении ДСр может стать значительной. [10]
Значительная аналитическая экстраполяция также необоснована: даже самые точные уравнения Ср ф ( Г) могут дать не только большое отклонение от опыта, но и не существующие в действительности максимумы; источником погрешности может служить и неточность уравнения Ср ср ( Т) в данной области температур; поэтому суммарная ошибка при вычислении АСР может стать значительной. [11]
Следовательно, и Д пар не является аддитивной величиной, так как на прямой, отвечающей соотношению ( II, 1), точки расположены не на одинаковом расстоянии. Неточность уравнения ( II, 91) станет значительной в области высоких давлений; наоборот, в стандартных условиях ( II, 91) будет практически соблюдаться. [12]
Недостаточно разреженные газы не вполне строго следуют законам Бойля и Ге-Люссака, для сильно сжатых газов уравнение Клапейрона становится непригодным. Неточность уравнения Клапейрона объясняется тем, что между молекулами газа существуют силы взаимодействия; силы взаимодействия нарушают равномерность и прямолинейность движения молекул; объем, занятый самими молекулами, уменьшает свободное пространство, в котором движение молекул может происходить беспрепятственно. [13]
В-третьих, в уравнение ( 5) не введены поправки, характеризующие отклонения от законов идеальных газов. Эта неточность уравнения также делает результаты подсчета по формуле ( 5) завышенными по сравнению с практически наблюдаемыми. [14]
Неточности уравнений ( 18) определяются доверительным интервалом энтальпии диссоциации. Оценить неточность уравнения ( 11) не представляется возможным, однако его использование нам кажется менее желательным, поскольку AS, рассчитанные по этому уравнению, не соответствуют статистическим значениям энтропии. [15]
Страницы: 1 2