Термодинамическая неустойчивость - металл
Cтраница 2
 |
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ МЕТАЛЛОВ В 3 % - ном ВОДНОМ РАСТВОРЕ NaCl ( ПО АКИМОВУ. [16] |
Основной причиной электрохимической коррозии является термодинамическая неустойчивость металла в данном электролите, величина которой определяется величиной стандартного электродного потенциала. Как правило, чем более отрицательное значение потенциала, тем менее термодинамически устойчив данный металл. Поскольку экспериментально и теоретически до сих пор не удается установить абсолютные значения потенциалов, то их определяют по отношению к стандартному водородному электроду, потенциал которого условно принимается равным нулю во всех средах и при всех температурах. Электродвижущую силу гальванического элемента, состоящего из стандартного водородного электрода и исследуемого электрода в растворе электролита, называют электродным потенциалом. [17]
Основной причиной коррозии металла трубопроводов является термодинамическая неустойчивость металлов. [18]
 |
Виды местной коррозии металла. [19] |
Основной причиной коррозии металла трубопроводов является термодинамическая неустойчивость металлов. [20]
 |
Схема работы корро знойного элемента. [21] |
Таким образом, истинной причиной коррозии является термодинамическая неустойчивость металла в данных условиях. [22]
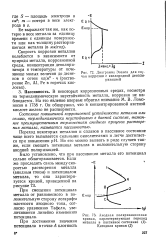 |
Диаграмма Эванса для случая коррозии с кислородной деполяризацией. [23] |
В некоторых коррозионных средах, несмотря на термодинамическую неустойчивость металла, коррозия не наблюдается. На это явление впервые обратил внимание М. В. Ломоносов в 1738 г. Он обнаружил, что в концентрированной азотной кислоте железо не растворяется. [24]
Основной причиной коррозии металла трубопроводов и резервуаров является термодинамическая неустойчивость металлов. [25]
В свете развитых представлений истинной причиной коррозии является термодинамическая неустойчивость металла в определенных условиях. Образование и работа микроэлементов - это лишь наименее энергоемкий из возможных путей перехода системы из термодинамически неустойчивого состояния в устойчивое. [26]
Скорость электрохимической коррозии определяется двумя факторами: степенью термодинамической неустойчивости металла в данном электролите и величиной общего кинетического торможения данной коррозионной системы. [27]
Причиной кислотной коррозии металлов, как и коррозии вообще является термодинамическая неустойчивость металла. Процесс коррозии, протекающий самопроизвольно, сопровождается уменьшением термодинамического потенциала и приводит к получению продуктов более устойчивых, чем металл в исходном состоянии. [28]
Химическая коррозия, имеющая место в этом случае, развивается в кислородсодержащих газах: иа воздухе, в углекислом газе, водяном паре, чистом кислороде в др. Движущей силой газовой коррозии является термодинамическая неустойчивость металлов в газовых средах при данных внешних условиях: давлении, температуре, составе среды и др. При этом на поверхности металла чаще всего образуется оксидная пленка. От структуры, состава и свойств этих пленок зависит скорость процесса газовой коррозии. Защитные свойства оксидных пленок в значительной степени определяются их сплошностью, которая зависит от отношения моля оксида к массе атома металла. [29]
Химическая коррозия, имеющая место в этом случае, развивается в кислородсодержащих газах: на воздухе, в углекислом газе, водяном паре, чистом кислороде и др. Движущей силой газовой коррозии является термодинамическая неустойчивость металлов в газовых средах при данных внешних условиях: давлении, температуре, составе среды и др. При этом на поверхности металла чаще всего образуется оксидная пленка. От структуры, состава и свойств этих пленок зависит скорость процесса газовой коррозии. Защитные свойства оксидных пленок в значительной степени определяются их сплошностью, которая зависит от отношения моля оксида к массе атома металла. [30]
Страницы: 1 2 3