Sd-электрон
Cтраница 4
Так как Sd-орбитальное облако четырех лопастное ( см. рис. 13), один и тот же Sd-электрон странствует ( делокализуется) по всем четырем лопастям, осуществляя перекрывание с орбитальными облаками четырех атомов азота и образуя связи с ними. [46]
Электронная конфигурация ( Ar) 3d 4s2; удалены могут быть как 4s -, так Sd-электроны, причем разница в энергиях 3d - и 45-электронов значительно меньше, чем у 3s - и Зр-электронов. [47]
Казалось бы, два электрона на 4-орбитали расположены выше ( дальше от ядра), чем Sd-электроны, но отталкиваются они от остальных электронов атома в действительности слабее и их энергия несколько меньше, чем на Sd-орбитали. Поэтому лишь после заполнения 45-оболочки может начаться заселение электронами более глубоких Зе. Это начинается со скандия, который наряду с шестью Зр-электронами имеет два 45-электрона и один 3 -электрон. [48]
 |
Полиморфное превращение железа. [49] |
В соответствии с усилением вклада ковалентной связи ( за счет 3d -, 4d - и Sd-электронов соответственно) в ряду Fe-Ru-Os теплота сублимации, температуры плавления и кипения заметно возрастают. [50]
 |
Полиморфные превращения железа. [51] |
В соответствии с усилением вклада ковалентной связи ( за счет 3d -, 4d - и Sd-электронов соответственно) в ряду Fe - Ru - Os теплота сублимации, температуры плавления и кипения заметно возрастают. [52]
Таким образом, у La 5йх - электрон следует рассматривать как несостоявшийся 4 / - электрон, а отнюдь не как первый Sd-электрон. Се атомов Pr, Nd, Pm, Sm, Eu, появление его лишь у Gd, с энергетически выгодной 4 / 7-конфигурацией, и дальнейшее исчезновение у следующих за Gd атомов ТЬ, Dy, Но, Er, Tm, Yb. Последний из названных элементов - Yb со строением [ Хе ] 4 / 145d 6s2 - отличается от последнего s - элемента - Ва со строением [ Хе ] 4 / 5d 6s2 - тем, что имеет полностью сформированную 4 / - подоболочку. В эюм случае правомерным становится и само название 4 / - элементов - лантаноиды. [53]
Особый интерес представляет первый переходный период, все элементы которого дают двух - и трехвалентные ионы, отличающиеся друг от друга числом Sd-электронов. [54]
Основой химической связи в металлоподобных нитридах является ds / 7-гибридизация волновых функций всех валентных электронных состояний, в которой наиболее активную роль играют Sd-электроны переходного металла и третий 2 / 7-электрон азота. [55]
Таким образом, этот ион имеет пустые 4s и три 4р - орбиты и может также освободить две Sd-орбиты, если его пять Sd-электронов разместятся на трех Sd-орбитах. Таким образом, всего ион Fe3 может иметь шесть пустых орбит и таким образом вступить во взаимодействие с шестью донорами. [56]
 |
Сравнение энергий нейтральных атомов и однозарядных катионов. [57] |
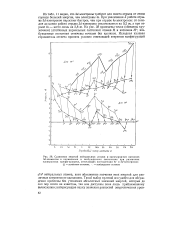
При увеличении Z работа отрыва Зс ( - электронов нарастает быстрее, чем при отрыве 4 -электронов: от скандия до цинка работа отрыва Sd-электрона увеличивается на 9 2 эв, а при отрыве 4s - всего лишь на 2 8 эв. На рис. 38 приведены точки ( обведены кружочком) устойчивых нормальных состояний атомов М и катионов М; возбужденные состояния отмечены точками без кружков. [58]
Взаимодействия между моментами РЗМ и переходных металлов, по-видимому, являются еще более сложными, так как они несомненно должны зависеть от электронных состояний Sd-электронов иона переходного металла. Если имеется 3d - no - лоса конечной ширины, то f - d - взаимодействие может происходить либо прямым путем, либо косвенным через поляризованное облако электронов проводимости, окружающее два иона. До сих пор опубликовано очень мало подробных обсуждений этого специфического взаимодействия. [59]
Если предположить, что атомы никеля или платины будут вступать в реакцию в основном состоянии, то в первую очередь должны были бы реагировать два Sd-электрона никеля и один 5d - и один Gs-электрон плагины. [60]
Страницы: 1 2 3 4