Дизамещенный бензол
Cтраница 2
Это означает, что образование конденсированной системы из двух циклов дает меньший выигрыш энергии, и в реакциях легче будет идти присоединение и превращение системы нафталина в систему дизамещенного бензола. [16]
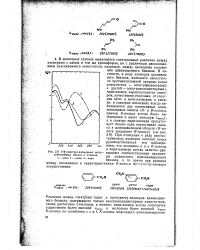 |
УФ-спектры изомерных меток - вышают соответствующие парамет-сибензойных кислот в этаноле. ры модельного монозамещенного. [17] |
В некоторых случаях выявляются спектральные различия между изомерами с одним и тем же хромофором, но с различным расположе - нием ауксохромного заместителя, например, между изомерами положения дизамещенного бензола. [18]
Переходы 1 - - - 1 ( и 2 - - - 2) горизонтально-поляризованы, как показано на рисунке табл. 8 - 1, и соответствуют La ( и Ва) полосам дизамещенного бензола. Состояние 3Ьа представляет собой низший триплет, и, таким образом, для синхронного, пути барьер, определяемый корреляцией состояний, отсутствует. Обычно это не имеет значения, так как далее реакция будет протекать по несинхронному семиротаторному пути, как уже обсуждалось выше. Однако для соединений, подобных XI, синхронный путь представляет интерес, поскольку можно было бы ожидать образования в качестве продукта реакции антрацена в возбужденном триплетном состоянии. [19]
Аналогичный эффект можно ожидать в случае производных пиридина, так что спектр поглощения пиридина с пятью свободными атомами водорода должен был бы походить в этой области частот на спектр поглощения замещенного бензола, тогда как у-пиколин, содержащий две пары свободных атомов водорода, должен в этом отношении походить на n - дизамещенный бензол. Насколько можно судить по имеющимся ограниченным данным, это предположение подтверждается на практике. Так, например, поглощение пиридина [2] при 750 см 1, а-пиколина [3] при 755 см 1, р-пиколина при 790 см 1 и у-пиколина при 800 см 1 сходно с картиной поглощения соответственно моно -, орто -, мета - и ш / ж-замещенных бензола. Эта корреляция с небольшими отклонениями [26] выполняется также для 8 этилпиридинов с различными заместителями и 19 замещенных метилпиридинов. Аналогичные результаты получены Куком и др. [41 ], которые также отметили характеристическое поглощение в области 2080 - 1650 см 1, подобное поглощению бензольных систем. [20]
Кольцо рассматривается как napa - дизамещенный бензол. Система координат выбрана таким образом, чтобы ось у была параллельна цепи, ось г - перпендикулярна плоскости кольца и проходила через центр кольца, а ось х - перпендикулярна обеим осям. [21]
Спектры этого же типа дают 7 - заме1Ченные пиридины ( см. рис. П-42), а также пятичленные гетероциклы - фуран ( см. рис. П-32), тиофен ( см. рис. П-33), пиррол, селенофен и другие, анализ которых - классические примеры в ЯМР-спектроскопии. Для пятичленных гетероциклов сходство с n - дизамещенными бензолами определяется тем, что константа спин-спиновой связи 0-про-тонов / н, н невелика по сравнению с / н н и по величине близка к / нета для производных бензола. [22]
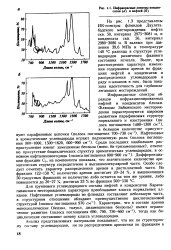 |
Инфракрасные спектры конденсатов ( а и нефтей ( б. [23] |
Для группового углеводородного состава нефтей и конденсатов Карача-ганакского месторождения характерно преобладание класса нормальных ал-канов. Характерно, что в составе аренов моноциклические ( бензол, толуол, дизамещенные бензолы) имеют ограниченное развитие ( полоса поглощения 690, 700, 750 - 660 см 1), тогда как 6и - циклические составляют основу класса углеводородов. [24]
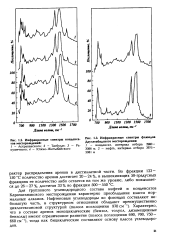 |
Инфракрасные спектры конденсатов месторождений.| Инфракрасные спектры флюидов Даулетабадского месторождения. [25] |
Для группового углеводородного состава нефтей и конденсатов Карачаганакского месторождения характерно преобладание класса нормальных алканов. Характерно, что в составе аренов моноциклические ( бензол, толуол, дизамещенные бензолы) имеют ограниченное развитие ( полоса поглощения 690, 700, 750 - 660см 1), тогда как бициклические составляют основу класса углеводородов. [26]
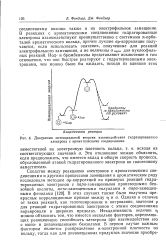 |
Диаграмма потенциальной энергии взаимодействия гидратированного электрона с ароматическими соединениями. [27] |
В этих случаях также были получены прекрасные корреляционные прямые между ц и а. Неаддитивность величин т) можно объяснить тем, что имеется несколько факторов, определяющих реакционную способность электрона при взаимодействии его с моно - и дизамещенными бензолами. [28]
Они могут быть выведены аналогично тому, как выводится число изомеров для моно -, ди - и тризамещенных бензолов. Заместителями в этом случае условно можно считать те ОН-группы, которые находятся на противоположной стороне кольца по отношению к большинству ОН-групп. Для молекул типа О-6 и 1 - 5, соответствующих незамещенному и мо-нозамещенному бензолу, может существовать лишь по одному изомеру. Молекула 2 - 4 отвечает дизамещенному бензолу и имеет три изомера, соответствующих орто -, мета -, пара-изомерам в ряду бензола. И, наконец, молекуле типа 3 - 3 отвечают еще три изомера, соответствующих рядовому, симметричному и несимметричному тризамещенным бензолам. При этом оказывается, что несимметричная форма здесь действительно оправдывает свое название: у нее нет ни плоскости, ни центра симметрии. Поэтому у данной формы появляется не совпадающее с ней зеркальное отражение; формулы 3 и И изображают эти два антипода. [29]
Как мы уже видели, при л-д - возбуждении электрон переходит с я-орбитали состояния S0 на более высоко лежащую л - орбиталь той же самой я-системы. Эти две орбитали перекрываются друг с другом в значительно большей степени, чем п - и л - орбитали. Кроме того, электронное облако в л л - состоянии более делокализо-вано, чем в п л - состоянии. С целью получить некоторое представление о реакционной способности различных состояний простых ароматических молекул была сделана попытка описать эти состояния в рамках простого метода МО [41 ], ив частности сравнить поведение дизамещенных бензолов с одной электронодонорнои или элек-троноакцепторной группой в обычном сольволизе с поведением родственных соединений в фотоиндуцированном сольволизе. [30]
Страницы: 1 2 3