Область - потенциал
Cтраница 1
Область потенциалов для электрохимического генерирования анион-радикалов определяется их сродством к электрону. Расход анион-радикалов у поверхности электрода в реакции с электроном может быть обнаружен электрохимически, например с помощью коммутаторной полярографии. [1]
Область потенциалов, соответствующая максимуму адсорбция поверхностно активных веществ, может быть установлена из - данных электрокапиллярной кривой. Адсорбция ионов имеет место только в определенном интервале потенциалов. При достаточно высоком отрицательном потенциале специфическая адсорбция прекращается. [2]
Область потенциалов, при которых реализуются средние заполнения поверхности продуктами хемосорбции. В этой области скорости процессов хемосорбции и удаления продуктов хемосорбции соизмеримы. [3]
Область потенциалов, заключенная между этими линиями, является областью электрохимической устойчивости воды. Область, лежащая ниже линии ab равновесных потенциалов водородного электрода, соответствует зоне разложения воды с выделением водорода. Область же, расположенная выше линии cd равновесных потенциалов кислородного электрода, соответствует зоне разложения воды с выделением кислорода. [4]
 |
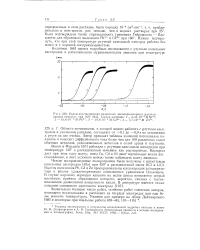
Кривые сила тока-потенциал, получаемые при поляризации ртутного электрода в растворах, содержащих различные ионы. [5] |
Область потенциалов, соответствующих нулевому значению тока, становится, наоборот, все уже и уже, если брать, например, растворы хлоридов марганца, цинка, кадмия и свинца ( она становится соответственно равной 1 6, 1 1, 0 6, 0 4 о), потому что разряд этих ионов идет с достаточно большой скоростью при все меньшей и меньшей разности потенциалов между металлом и раствором. [6]
Область потенциалов, в которой начинается-и заканчивается процесс адсорбции ( и. В пределах изменения концентрации этого вещества области потенциалов адсорбции и десорбции тоже сильно меняются. Электрокапиллярные кривые, а еще более четко поляризационные кривые показывают, что при малых концентрациях поверх-постно-активного вещества, имеющего четкую границу потенциалов адсорбции и десорбции, области потенциалов равны примерно 0 2 - 0 4 в для адсорбции и 0 5 - 0 8 в для десорбции, в то время как при больших концентрациях эти области сужаются до 0 10 - 0 15 в и 0 10 - 0 20 в соответственно. Отсюда вытекает, что поверхностно-активные вещества, присутствующие в малой концентрации, будут очень различно подавлять полярографические максимумы при разных потенциалах. [7]
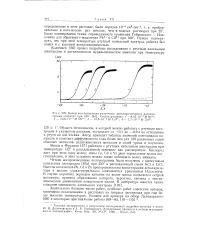 |
Волны восстановления различных деполяризаторов в расплавленных нитратах при 160 [ 64J. Состав расплава. 1 - 8 43 - Ю 3 М Ni2. 2 - Ю. б - КГ3 М РЬ2. 3 - 10 6 - 1 ( Г3Л1 Cd2. 4 - 7 7 - КГ3 М Zn2. [8] |
Область потенциалов, в которой можно работать с ртутным электродом в указанном расплаве, составляет от 0 1 до - 0 9 в по отношению к ртути на дне ячейки. Автор приводит таблицы значений потенциалов полуволн и констант диффузионного тока более чем для 100 различных солей обычных металлов, редкоземельных металлов и солей урана и плутония. [9]
Область потенциалов при этом в растворах с Fe менее размыта ( см рис. 1, кривые 2, 3, 5), что указывает на более быструю пассивацию поверхности электрода в этих растворах. [10]
Область потенциалов, в которой можно работать с ртутным электродом в указанном расплаве, составляет от 0 1 до - 0 9 в по отношению к ртути на дне ячейки. Автор приводит таблицы значений потенциалов полуволн и констант диффузионного тока более чем для 100 различных солей обычных металлов, редкоземельных металлов и солей урана и плутония. [12]
Область потенциалов, в которой можно наблюдать реакцию на ртутном капельном электроде, ограничена при положительных потенциалах большим током, соответствующим окислению ртути, и при отрицательных потенциалах - током, обусловленным реакцией восстановления растворителя или фонового электролита. [13]
Область потенциалов, которая может быть использована при работе с ацетонитриль-ными растворами, была определена применительно к различным условиям. [14]
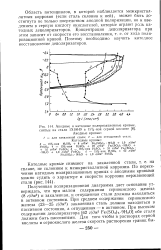 |
Анодные и катодные поляризационные кривые, снятые на стали 1Х18Н9 в 15 % - ной серной кислоте. [15] |
Страницы: 1 2 3 4 5