Область - протекание - процесс
Cтраница 1
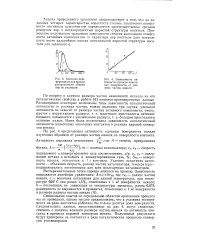
Области протекания процесса: а - внешнедиффузионная; б - внутридиффузионная; в-кинетическая. [2]
Определение области протекания процесса - кинетическая, диффузионная, смешанная ( см. гл. [3]
Чтобы установить область протекания процесса, необходимо скорость диффузии и химической реакции определять отдельно. [4]
Обычно зная область протекания процесса, технологи выбирают основные параметры, наиболее сильно влияющие на скорость процесса. В этом случае выражение для расчета коэффициента скорости процесса упрощается. [5]
Если известна область протекания процесса горения, то найти Gc можно, воспользовавшись зависимостями, приведенными выше. В кинетической области горения Gc не зависит от размера частиц и выражение ( 7 - 38) легко интегрируется. [6]
Для определения области протекания процесса его проводят при различных все возрастающих температурах. При этом общая скорость процесса может либо увеличиваться, либо оставаться практически постоянной. Повышение общей скорости процесса при повышении температуры происходит только для процесса, протекающего в кинетической области, за счет увеличения скорости самой медленной его стадии - химической реакции. Если же с увеличением температуры общая скорость процесса практически не увеличивается, то это значит, что она зависит не от скорости химической реакции, а от скорости диффузии ( на скорость диффузии температура почти не влияет) - процесс идет в диффузионной области. [7]
Режим ( или область протекания процесса) и лимитирующая стадия - понятия и характеристики, присущие многостадийному процессу. [8]
Кинетическая и диффузионная области протекания процесса. [9]
Вопрос о выборе области протекания процесса усложняется в случае многоступенчатых реакций. При этом максимальная селективность и скорость процесса могут иметь место как в чисто кинетической или чисто диффузионной области ( по всем компонентам, способным к дальнейшему превращению), так и в смешанной области, когда имеет место фазовое равновесие по одним компонентам и отсутствует по другим. [10]
Для теоретического определения области протекания процесса необходимо оценивать скорости процесса диффузии и химической реакции раздельно, как для независимых процессов. Соотношения этих скоростей определяют область протекания процесса в целом. При стационарном протекании реакции термин диффузионная область вовсе не означает, следовательно, что действительная скорость реакции на реакционной поверхности более скорости процесса диффузии к этой поверхности. Благодаря медленности подвода веществ на поверхность, скорость химической реакции на поверхности принудительно становится равной скорости процесса диффузии. Концентрация вещества на поверхности при этом мала, а градиент концентрации около поверхности получается большим. Наоборот, в кинетической области, когда независимо определенная скорость диффузии значительно превышает скорость реакции, равенство скоростей диффузии и реакции наблюдается при мало отличающихся значениях концентраций реагирующих веществ в объеме и на поверхности. [11]
Для теоретического определения области протекания процесса необходимо оценивать скорости диффузии и химической реакции отдельно, как скорости независимых процессов. Отношение определенных таким образом скоростей указывают область протекания процесса в целом. При стационарном протекании реакции термин диффузионная область вовсе не означает, следовательно, что действительная скорость реакции на реакционной поверхности больше скорости диффузии к этой поверхности. Обе эти скорости равны, но благодаря медленному притоку веществ к поверхности скорость химической реакции на поверхности принудительно становится равной скорости диффузии. Концентрация вещества на поверхности при этом мала, а градиент концентрации вблизи поверхности оказывается большим. И наоборот, в кинетической области, где независимо определенная скорость диффузии значительно превышает скорости реакции, равенство скоростей диффузии и реакции наблюдается при мало отличающихся значениях концентраций реагирующих веществ в объеме и на поверхности. [12]
Для теоретического определения области протекания процесса необходимо оценивать скорости диффузии и химической реакции отдельно, как скорость независимых процессов. Отношение определенных таким образом скоростей указывают область протекания процесса в целом. При стационарном протекании реакции термин диффузионная область вовсе не означает, следовательно, что действительная скорость реакции на реакционной поверхности больше скорости диффузии к этой поверхности. Обе эти скорости равны, но благодаря медленному притоку веществ к поверхности скорость химической реакции на поверхности принудительно становится равной скорости диффузии. Концентрация вещества на поверхности при этом мала, а градиент концентрации вблизи поверхности оказывается большим. И, наоборот, в кинетической области, где независимо определенная скорость диффузии значительно превышает скорости реакции, равенство скоростей диффузии и реакции наблюдается при мало отличающихся значениях концентраций реагирующих веществ в объеме и на поверхности. [13]
Для математического описания области наилучшего протекания процесса использовано ортогональное планирование второго порядка; при этом в качестве ядра планирования был использован факторный план первой серии опытов ( табл. 2 опыты 1 - 16), дополненный звездными точками ( табл. 2 опыты 17 - 24) с величиной звездного плеча. [14]
 |
Типичная дифференциальная кривая распределения объема пор по радиусам.| Зависимость активности единицы никелевой поверхности от размера частиц никеля. [15] |
Страницы: 1 2 3 4
