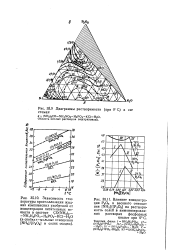
Область - кислый раствор
Cтраница 1
Область кислых растворов заштрихована. [2]
Поскольку в области кислых растворов протеин содержит свободные основные группы, а в щелочной области свободные кислотные группы, облегчение растекания может быть объяснено образованием солей из ионов раствора и молекул протеина в пленке. [3]
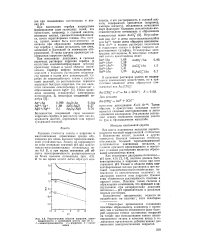 |
Теоретические области коррозии, невосприимчивости и пассивации золота при 25 С. / - невосприимчивость. 2 - коррозия. 3 - пассивация. [4] |
Только в области очень концентрированных кислых растворов и при высоких окислительно-восстановительных потенциалах ( в окислительных условиях) на диаграмме имеется зона коррозии. Именно этим объясняется растворимость платины в царской водке. Платина также склонна к образованию комплексов, что приводит к затруднениям1 при интерпретации диаграмм потенциал - рН применительно к реальным водным растворам. [5]
Для большинства белков ИЭТ лежит в области кислых растворов. Положение ИЭТ зависит от наличия солей в растворе. Некоторые анионы, например CNS -, сдвигают ее в кислую сторону, а катионы, особенно многовалентные, - в щелочную. Изменение свойств растворов белков вблизи ИЭТ связано с изменением формы белковых макромолекул. Их форма имеет резко выраженную зависимость от рН среды. [6]
Герен и Мартэн [ 161 изучили ту же систему при 609, включив и область очень кислых растворов. [7]
Для многих металлов, в ряду напряжения стоящих выше ( отрицательнее) водорода, это условие выполняется в области кислых растворов. [9]
 |
Диаграмма Пурбе для цинка. [10] |
Так, например, из диаграммы е-р Н для цинка ( рис. 90) видно, что в области кислых растворов при потенциалах выше прямой J, цинк растворяется, давая гидратированные ионы Zntq. К моменту достижения рН 6 5 возможно образование слаборастворимой гидроокиси цинка Zn ( OH) 2 и растворение цинка затрудняется. [11]
Необходимо подчеркнуть, что такой переход реакции от необратимой к обратимой является следствием того механизма, который мы приняли для нее в области кислых растворов. В более щелочных растворах ход поляризационной кривой определяется уже закономерностями концентрационной поляризации. В частности, при увеличении рН раствора потенциал восстановления должен меняться по такой же зависимости, как и потенциал равновесного окислительно-восстановительного электрода системы кислород - перекись водорода. [12]
 |
Равновесие в системе Ca ( NO3 2 - HNO3 - H2O при 25. [13] |
Эти области ограничены кривой N MiMN растворимости кристаллогидратов в кислых растворах и линиями перехода кристаллогидратов. Ниже и левее линии растворимости находится область ненасыщенных кислых растворов. [14]
 |
Диаграмма плавкости системы Na-F - KF - MgF2. [15] |
Страницы: 1 2