Область - устойчивое пассивное состояние
Cтраница 3
При исследовании поляризации сплавов титана с платиной и палладием в соляной кислоте получены аналогичные кривые с приведенными на фиг. Стационарные потенциалы сплавов вследствие снижения перенапряжения водорода оказываются сильно сдвинутыми в положительную сторону по сравнению со стационарным потенциалом титана, так, что, например, в соляной кислоте до 20 % - ной концентрации потенциалы сплавов оказываются в области устойчивого пассивного состояния. [31]
Область пассивного состояния металла находится между потенциалом р к потенциалом перезащиты ( рпп. В тех случаях, когда область устойчивого пассивного состояния составляет 1 5 В и более для поддержания пассивного состояния достаточно подключить к катоду и аноду низкоомный источник постоянного тока, например, аккумуляторную батарею, с устройством для изменения напряжения в нешироком интервале с учетом омического сопротивления в электролите. [32]
Электрохимическое поведение исследуемых сталей мало отличается одно от другого. Однако с ростом температуры ( 80 - 90 С) стационарный потенциал изменяется до - 0 5 В, а сталь подвергается значительной коррозии. Стационарный потенциал стали 10Х17Н13М2Т находится в области устойчивого пассивного состояния ( 0 1 В) при температурах до 50 С. Выше этой температуры происходит активация стали до потенциалов - 0 7 В, что соответствует области активного растворения ее. Хромоникелевая сталь 12Х18Н10Т наименее устойчива в стационарных условиях. [33]
Та модифицирование 0 2 % Pt дает дальнейшее повышение устойчивости. Сплав Nb 30 % Ta 0 2 % Pt по коррозионной стойкости приближается к чистому танталу. Механизм положительного влияния платины вполне аналогичен обсужденному выше и определяется также смещением потенциалов коррозии в область устойчивого пассивного состояния сплава Nb - Та, при накоплении на поверхности достаточного количества платины. [34]
Для уменьшения коррозии хранилищ, выполненных из Ст 3, применена анодная электрохимическая защита. Стационарный потенциал Ст 3 лежит в области активного растворения и равен - 0 4 В. Область устойчивого пассивного состояния имеет протяженность 0 7 В; причем, с изменением концентрации серной кислоты колеблется незначительно. [35]
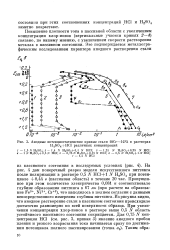 |
Анодные потенциостатические кривые стали 18Сг - 14N1 в растворах H2S04 HC1 различных концентраций. [36] |
На рис. 4 дан поперечный разрез модели искусственного питтинга после поляризации в растворе 0 5 N НС1 1 N H2S04 при потенциале 0 44 в ( пассивная область) в течение 20 час. Пропущенное при этом количество электричества 0 081 к соответствовало глубине образования питтинга в 67 мк ( при расчете на образование Fe3, Ni2, Сг 3), что находилось в полном согласии с данными непосредственного измерения глубины питтинга. Из рисунка видно, что анодное растворение стали в пассивном состоянии происходило достаточно равномерно по всей поверхности образца. При увеличении концентрации хлор-ионов в растворе выше 0 5 N область устойчивого пассивного состояния сокращается. [37]
В настоящее время все более широкое распространение получают различные циркуляционные установки и испытательные стенды, на которых стремятся с наибольшей достоверностью воссоздать условия эксплуатации металла или сплава. Однако несовершенство методик воспроизведения условий обтекания поверхности металла электролитом приводит к разноречивым экспериментальным данным и делает некорректным перенесение результатов лабораторных исследований на реальные объекты. Так, Л. М. Яковлев и А. В. Турковская [67] изучали коррозионно-электрохимическое поведение нержавеющих сталей Х17Н13М2Т, Х17Н13МЗТ и 0Х22Н5Т в серной кислоте; электрохимические измерения проводились на вращающемся дисковом электроде, а коррозионные испытания-на специальной установке с трубчатыми образцами. Ими показано, что при движении серной кислоты скорость коррозии не увеличивается и область устойчивого пассивного состояния сплава может расширяться. [38]
Марганец и молибден увеличивают скорость коррозии, а бор ( даже - 0 4 %) уменьшает ее. Межкристаллитная коррозия практически возможна в серной кислоте при потенциалах от 0 до 0 3 В и имеет максимум при 0 15 В. Она вызвана обеднением гранул зерен хромом. Поэтому стали, склонные к межкристаллитной коррозии, можно эксплуатировать, если их стационарный потенциал лежит в области устойчивого пассивного состояния. [39]
 |
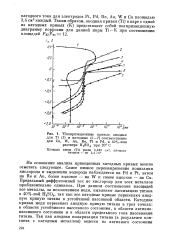
Влияние концентрации NH4NO3 на скорость коррозии Ст. З при постоянном рН и потенциале - 0 52 В. [40] |
Однако дальнейшее увеличение концентрации аммиака сопровождается повышением критической плотности тока пассивации и скорости активного растворения. Зависимость гКр от рН в таких смешанных растворах имеет экстремальный характер. Увеличение 1д и / кр связано как с повышением рН раствора, так и с увеличением общей концентрации аммиака. Добавки аммиака ( 0 5 - 1 %) приводят не только к снижению плотности тока первичной пассивации, но и к расширению области устойчивого пассивного состояния. Таким образом, аммонизация растворов сульфата и нитрата аммония не только позволяет обогащать удобрения азотом, но и облегчает режим анодной защиты. В ряде случаев аммонизация нитрат-сульфатных растворов дает возможность перевести Ст. [41]
 |
Поляризационные кривые, анодная. [42] |
На основании анализа приведенных катодных кривых можно отметить следующее. Самое низкое перенапряжение ионизации кислорода и выделения водорода наблюдается на Pd и Pt, затем на Re и Аи, более высокое - на W и самое высокое - на Си. Предельный диффузионный ток по кислороду для всех металлов приблизительно одинаков. При данном соотношении площадей все металлы, за исключением меди, вызывают пассивацию титана в 40 % - ной H2S04, так как все катодные кривые пересекают анодную кривую титана в устойчивой пассивной области. Катодная кривая меди пересекает анодную кривую титана в трех точках: в области устойчивого пассивного состояния, в области активно-пассивного состояния и в области предельного тока пассивации титана. [43]
Видно, что ниобий ( кривая /) и сплав ниобия с 5 % тантала ( кривая 2) растворяются в указанных условиях с возрастающими скоростями. Скорость коррозии ниобия и его сплавов с 5 % Та, дополнительно легированных 0 2 Pt ( кривые 1 и 2), в начальный момент достаточно высокая, а затем быстро снижается в течение первых 10 час. На сплавах Nb-30 % Та модифицирование 0 2 Pt дает дальнейшее повышение устойчивости. Сплав Nb-30 % Та-0 2 Pt по своей устойчивости уже приближается к чистому танталу. Механизм положительного влияния платины вполне аналогичен обсужденному выше и определяется также смещением потенциалов коррозии в область устойчивого пассивного состояния сплава Nb-Та при накоплении на поверхности достаточного для этого количества платины. [44]
Испытания, проводимые в соответствии с этим ГОСТом, дают удовлетворительные результаты. Однако в ряде случаев отмечается, что материалы, не показавшие склонность к МКК при стандартных испытаниях, в производственных условиях подвергаются МКК - Это может происходить по различным причинам. При этом они могут и не утратить способности к пассивированию в контрольной среде, но плотность тока в пассивном состоянии, положение и границы области устойчивого пассивного состояния все же изменяются. В этом случае обедненные зоны хоть и будут разрушаться быстрее, чем основной металл, но МКК пойдет медленнее и при испытаниях не проявится, так как для этого могут потребоваться не десятки, а сотни часов. Поэтому, учитывая несовершенство методов оценки результатов испытаний ( загиб, изменение звука и др.), часто приходится в сомнительных случаях повторять испытания. Кроме того, получаемый результат может быть неодинаков для разных образцов одного материала, даже в пределах одного образца часто отмечается различие в устойчивости границ зерен. [45]
Страницы: 1 2 3 4