Область - существование - пар
Cтраница 1
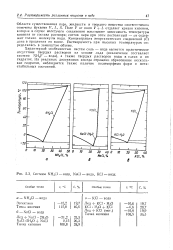 |
Системы NH4C1 - вода, NaCl - вода, КС1 - вода. [1] |
Области существования пара, жидкости и твердого вещества соответственно отмечены буквами V, L, S. Поле V от поля V - f - L отделяет кривая кипения, которая в случае нелетучего соединения показывает зависимость температуры кипения от состава раствора; состав пара при этом постоянный - он содержит только молекулы воды. Концентрация неорганических соединений ( С) дана в процентах по массе. [2]
На рис. 11 видны области существования пара, жидкого углерода, твердого графита и твердого алмаза. Последний, как видно, устойчив лишь при высоких давлениях. На диаграмме видна критическая точка К. [3]
На диаграмме в любой точке, которая находится в пределах области существования пара, жидкости или кристаллов, система будет однофазной и обладает двумя степенями свободы. [4]
Если же при фиксированной температуре изменить давление, то появится либо область, где вода стабильна только в жидком состоянии, либо область существования пара. [5]
Область, расположенная ниже кривых АОВ, является областью существования пара; выше СОВ - жидкости, выше и левее АОС - обычного льда. Так, продвижение по горизонтальной прерывистой линии от точки х до точки у будет связано со следующими превращениями. В точке х при давлении 1 атм и температуре 7 устойчив лед. Здесь повышение температуры приостанавливается: при продолжающемся подводе теплоты происходит изотермический фазовый переход лед рь вода. Когда лед полностью расплавится, фигуративная точка продолжает движение вправо, что будет означать нагревание уже жидкой воды. [6]
Область, расположенная ниже кривых АОВ, является областью существования пара; выше СОВ - жидкости, выше и левее АОС - обычного льда. Так, продвижение по горизонтальной прерывистой линии от точки х до точки у будет связано со следующими превращениями. В точке х при давлении 1 атм и температуре 7 устойчив лед. Здесь повышение температуры приостанавливается: при продолжающемся подводе теплоты происходит изотермический фазовый переход лед ч вода. Когда лед полностью расплавится, фигуративная точка продолжает движение вправо, что будет означать нагревание уже жидкой воды. [7]
 |
Приближенное плоское изображение молекулярной структуры воды. [8] |
Область, расположения ниже кривых АОВ, является областью существования пара, выше СОВ - жидкости, выше и левее АОС - обычного льда. Так продвижение по горизонтальной прерывистой линии от точки х до точки у будет связано со следующими превращениями. В точке х при давлении 1 атм и температуре 7 устойчив лед. Здесь повышение температуры приостанавливается: при продолжающемся подводе теплоты происходит изотермический фазовый переход лед вода. [9]
Так как в этом случае система однокомпоиентна, одновременно может существовать не более трех фаз, например лед, жидкость, пар. Исследование фазовых равновесий сводится к изучению кривых / / ( 7I, P), ограничивающих область существования пара, жидкости и твердого тела. Если вещество в твердом состоянии образует полиморфные модификации, то определяют область температур и давлений, в которой каждая из модификаций находится в устойчивом состоянии. [10]
Так как в этом случае система однокомпонентна, одновременно может существовать не более трех фаз, например лед, жидкость, пар. Исследование фазовых равновесий сводится к изучению кривых / / ( Г, /), ограничивающих область существования пара, жидкости и твердого тела. Если вещество в твердом состоянии образует полиморфные модификации, то определяют область температур и давлений, в которой каждая из модификаций находится в устойчивом состоянии. [11]
Верхняя искривленная поверхность внутри изображенного параллелепипеда показывает давление пара в зависимости от температуры и состава жидкости. Выше нее находится область существования жидкости. Ниже нее располагается область существования пара. Между поверхностями жидкости и пара находится область условий, отвечающих равновесному сосуществованию раствора и пара. [12]
Верхняя искривленная поверхность внутри изображенного параллелепипеда показывает давление пара в зависимости от температуры и состава жидкости. Выше нее находится область существования жидкости. Ниже ее располагается область существования пара. Между поверхностями жидкости и пара находится область условий, отвечающих равновесному сосуществованию раствора и пара. [13]
Одной из главных особенностей систем соль - вода является практическое отсутствие твердых растворов на основе льда ( исключение представляет фтористый аммоний) и твердых растворов воды в солях или гидратах. Диаграмма первого вида отражает образование безводной соли ( SA), второго - гидрата ( S-J, растворимого конгруэнтно, третьего - гидрата ( Si), растворимого инконгруэнтно. Буквами V, L и S обозначены области существования пара, жидкости и твердого вещества; буквой S0 обозначен лед. Поле V от поля V L отделяет кривая кипения. В случае нелету - ей соли эта кривая показывает зависи - Npib температуры кипения от состава явора; состав пара при этом постоян-4 - он содержит только воду. [14]
Страницы: 1